研究内容
1.光合成反応中心のエネルギー変換機構
1-2. 緑色イオウ細菌の反応中心
1-2-1. 分光学的手法による機能解析
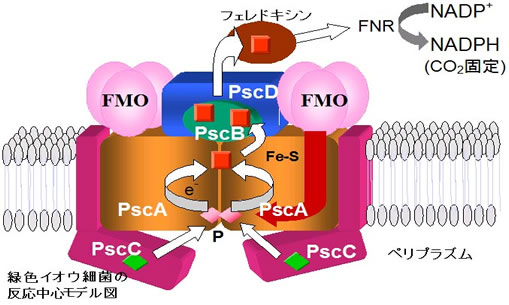
絶対嫌気性である緑色イオウ細菌クロロビウムChlorobiumの光化学反応中心は酸素に対して非常に不安定であり、1990年代に入るまでその生化学的解析は手つかずの状態でした。すでに説明してきましたが、1985年に報告された紅色細菌の反応中心の立体構造は、一次構造の情報と相俟って、シアノバクテリアや高等植物の光化学系IIとの構造・機能上の類似性が認識され、反応中心の進化的連続性が明らかとなりました。それがゆえに緑色イオウ細菌の反応中心を解析していくことの重要性が指摘され、反応中心の研究の機運が一気に盛り上がったわけです。1990年、私たちも緑色イオウ細菌から反応中心複合体を単離する研究に着手しました。反応中心は酸素に対して非常に不安定なものでしたが、嫌気的手法を導入し、好熱性の緑色イオウ細菌(Chl. tepidum)から安定な標品を得ることにようやく成功しました(1995年)。今日までこの標品を用い、分光学的諸性質や色素組成および新規なクロロフィル構造を報告してきました。純度の高い安定標品を調製できるのは、私たちのグループを含め世界でもごく限られたグループのみです。私たちの研究成果は常に世界の研究グループに影響を与え、高い評価を受けています。ここでは順次、これらの成果を説明していきたいと考えています。
反応中心に存在する2分子のチトクロムcz
嫌気的手法を導入し、緑色イオウ細菌Chl.
tepidumから5本のサブユニット(コア:65 kDa、FMO:41
kDa、FA/FB:31 kDa、cyt cz:22 kDa、18 kDa
タンパク)から構成される反応中心複合体標品を精製することに成功しました。すでに反応中心にはFe-Sセンター(FA、FB、FX)の存在していることを報告していたのですが(Oh-oka et al. 1993)、酸化還元差スペクトルはP840あたり2個のヘムcの存在を示唆していました(Oh-oka et al. 1995a)。そこで今回得られた完全な標品を用い、連続フラッシュ照射実験から、この複合体標品にはモノヘム型のチトクロムcが2分子結合していることを明らかにしたのです(Oh-oka et al. 1995b)。いずれこの2分子のチトクロムcの反応特性(特に等価な存在であるかどうか)については詳細に研究したいと考えています。
揺らぐチトクロムcz
私たちは非常に面白いことと思っているのですが、反応中心P840(バクテリオクロロフィルaの二量体)への電子供与体として働くチトクロムczが、構造的に大きく"揺らぎ"ながら機能していることを見いだしました。この反応様式については近年の溶液反応論(反応溶液中の粘性の影響を考慮した反応速度論)を基に理論的考察を加えました(Oh-oka et al. 1997)。溶液反応論を専門とする海外の研究者からの問い合わせもあり、いずれ機会があれば詳細な反応機構を解析していきたいと考えています。またこのチトクロムcの構造的揺らぎには生理学的にも意味があり、可溶性の電子伝達タンパクを介さずに、キノール酸化還元酵素(b/c1 複合体)から直接電子を受けとっていることを証明しています(Oh-oka et al. 1998a)。
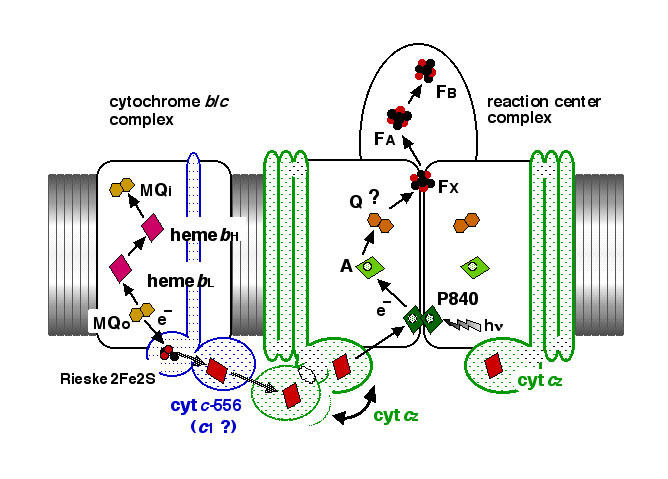
一次電子受容体(A0)の分光特性
複合体標品には複数個(約8-9個)のクロロフィル色素(Chl a670)が含まれています(Takaichi et al. 1999)。これらの機能と存在形態について、ウレア処理標品の閃光照射後のスペクトル変化を解析することにより調べました。その結果、一次電子受容体(A0)成分として機能する一方、その他のChl a670はアクセサリー色素としてP840周辺に存在していることが示されました(Iwaki et al. 1999)。
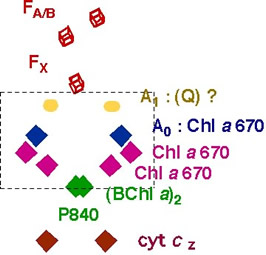
緑色イオウ細菌の電子伝達成分(モデル)
新規なクロロフィル構造
クロロフィル色素(Chl a670)は、1980年代はじめにはすでにその存在が報告されていましたが、機能および構造は不明でした。クロロフィルaと同じ吸収スペクトルを示すことから、バクテリオクロロフィル663(BChl 663、663nmにQYピークを示す)と呼ばれていたに過ぎません。私たちは一次電子受容体(A0)成分として機能することを明らかにするとともに、その構造についてもNMRという手法で明らかにすることができました(Kobayashi et al.
2000)。興味深いことに、この色素の環構造はバクテリアの光化学反応中心から抽出されたものであるに関わらず、植物タイプの光化学反応中心に見いだされる色素と同じクロリン環(Chl
a タイプ)であり、唯一異なるのはアルコール側鎖には二重結合がさらに1個付加していたことでした。Fe-Sタイプ(タイプ1)反応中心の一次電子受容体(A0)として機能する色素は、すべて高等植物型であることが明らかとなりました。多様な光合成色素の機能をより深く理解していく上で、私たちの研究成果は非常に重要な情報を提供しました。さらにこのクロロフィル色素(Chl
aPDという名前で呼ぶようになります)の合成経路について、2006-2008年には分子遺伝学的手法を用いて解析することになりました(3-3. ゲラニルゲラニル還元酵素を参照)。
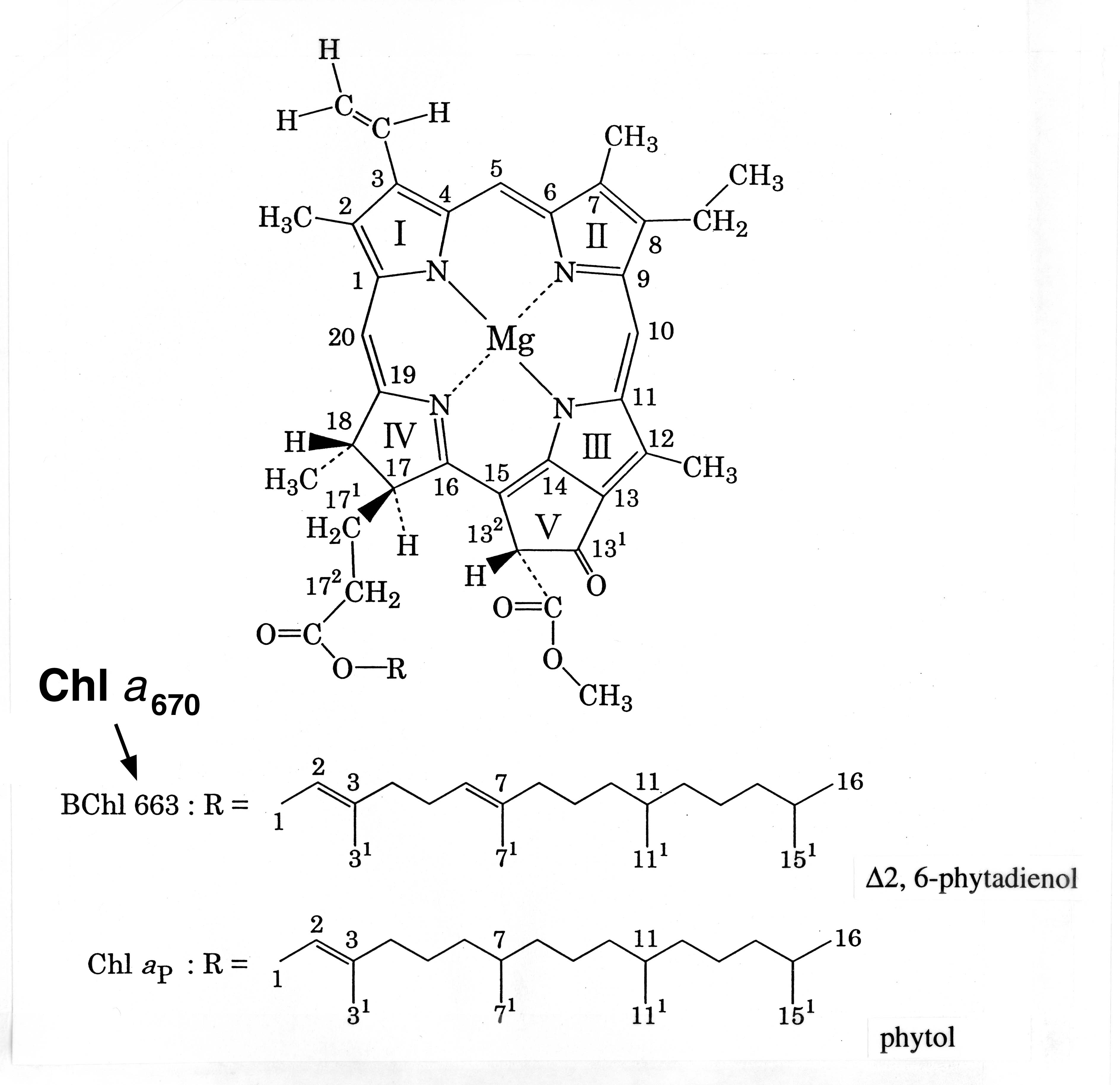
新規なクロロフィル色素(一次電子受容体)の構造
1-2-2. 分子生物学的手法による機能解析
緑色イオウ細菌の形質転換系はようやく確立されました(2001年)。またChlorobaculum tepidum(Chlrobium tepidumから改名)の全ゲノム情報も時を同じくして公開されています。私たちはいよいよ分子生物学的手法を用いて、緑色イオウ細菌の反応中心解析に着手し始めました。以下、順次その結果を報告していく予定です。
PscD 欠損株の解析
緑色イオウ細菌Cba. tepidumは5本のサブユニット(PscA-DとFMO)から構成されています。私たちはこの中で、機能未知であった18kDaタンパク(PscD)の破壊株を作成することに成功しました(Tsukatani
et al. 2004)。PscDサブユニットのアミノ酸配列は、光化学系I複合体(シアノバクテリアや高等植物)のPsaDサブユニットのアミノ酸配列とわずかながらsimilarityが存在しています。それゆえ系I複合体のPsaDサブユニットの機能と同様に、緑色イオウ細菌反応中心においてもFA/FBタンパク(PsaB)の安定化に寄与し、あるいはフェレドキシンのdocking site(結合部位)として機能しているのではないかと推測されていました。私たちはPsaD欠損株から膜標品を調製し、閃光照射後の時間分解蛍光スペクトル変化を測定しました。そしてこの変異株ではFMOからP840へのエネルギー移動速度が遅くなっていることを見いだしました。さらにNADP+光還元速度も野生株に比較して若干遅くなっていることが分かりました。つまりPsaDサブユニットはエネルギー移動とフェレドキシン還元反応の促進の両方に関与していたわけです。一方、電顕解析からはPsaDサブユニットがFA/FBタンパクと同じ細胞質側に存在していることを示唆する観察結果が得られており、このことは私たちの結論を支持しています。そして始原型反応中心ではbifunctionalな機能を有していたPscDサブユニニットが、光化学系I複合体(シアノバクテリアや高等植物)へと進化していく中で、フェレドキシン還元反応のみに特化していったのではないかと推測しています。このサブユニットは細菌型と高等植物型のタイプ1反応中心とを結びつけるmissing
linkであるかも知れません。一見大胆な仮説ですが、今後、PscDサブユニニットの機能を部位特異的変異等の手法で詳細に解析していくことにより検証していくことができるものと考えています。
(補訂)PscA-Dの名称について
緑色イオウ細菌の反応中心複合体を構成するサブユニットをコードする遺伝子はpscA, B, C, Dとfmoである。それぞれコアタンパク:PscA、FA/FBタンパク:PscB、チトクロムCZ:PscC、18kDaタンパク:PscD、FMOタンパク、と呼ばれる。ちなみに光化学系Iを構成するサブユニット遺伝子はpsa、光化学系IIはpsb、ヘリオバクテリアはpshの名前でそれぞれ呼ばれる。
人工的ヘテロダイマー化への試み
緑色イオウ細菌は光独立栄養細菌であり、光合成的にしか生育できない。それゆえ光合成反応系への変異導入によって不活化してしまうと生きていくことはできない。ここでは反応中心に部位特異的変異を導入するための実験系を確立することを目的に、ゲノム上のrecA遺伝子領域内に第2のpscA遺伝子を挿入し、反応中心を人工的にヘテロダイマー化する戦略の有効性について検討した。今後、第2のpscA遺伝子に変異を導入し、ホモダイマー型反応中心内の2方向の電子移動制御を実験的、理論的に研究していくことが可能である。
(参考文献)C. Azai, K. Kim, T. Kondo, J. Harada, S. Itoh and H. Oh-oka A heterogeneous tag-attachment to the homodimeric type 1 photosynthetic reaction center core protein in the green sulfur bacterium Chlorobaculum tepidum Biochim. Biophys. Acta 1807 , 803 - 812 (2011)
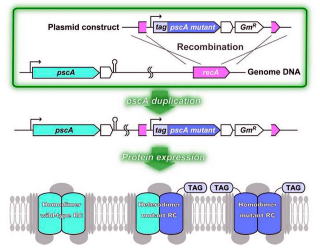
(説明)ゲノム上のrecA遺伝子領域内に導入した第2のpscA遺伝子の5'末端にはタグを付加している。本論文ではHisタグを付加し、Ni-NTA樹脂によるアフィニティクロマトで精製可能であった。また質量分析LC-MS/MSでは、人工的ヘテロダイマーの存在が確認できた(片方のサブユニットのみにHisタグが付加していた)。

