研究内容
3.光合成色素の合成経路
3-1. はじめに
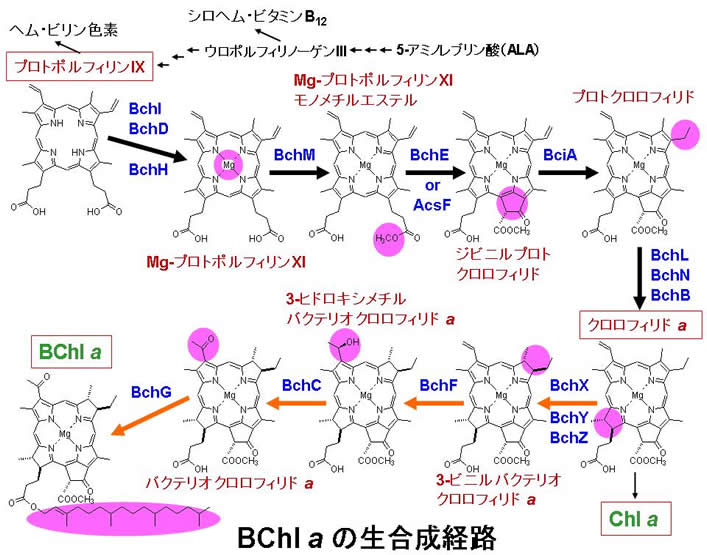
光合成色素の合成経路は研究概要でも触れましたが、非常に複雑な反応経路です。前駆体である5-アミノレブリン酸(ALA)から何段階もの反応ステップを経て、環状テトラピロールが出来上がります(プロトポルフィリンIX)。この経路上で、ビタミンB12、およびヘム合成経路との分岐点が存在しているのが特徴です。下図は、プロトポルフィリンIXからバクテリオクロロフィルa(BChl a)までの反応ステップを示しています。このように描けばすべて分かってしまっているような気になりますが、まだまだ不明な点が残されているのが現状です。
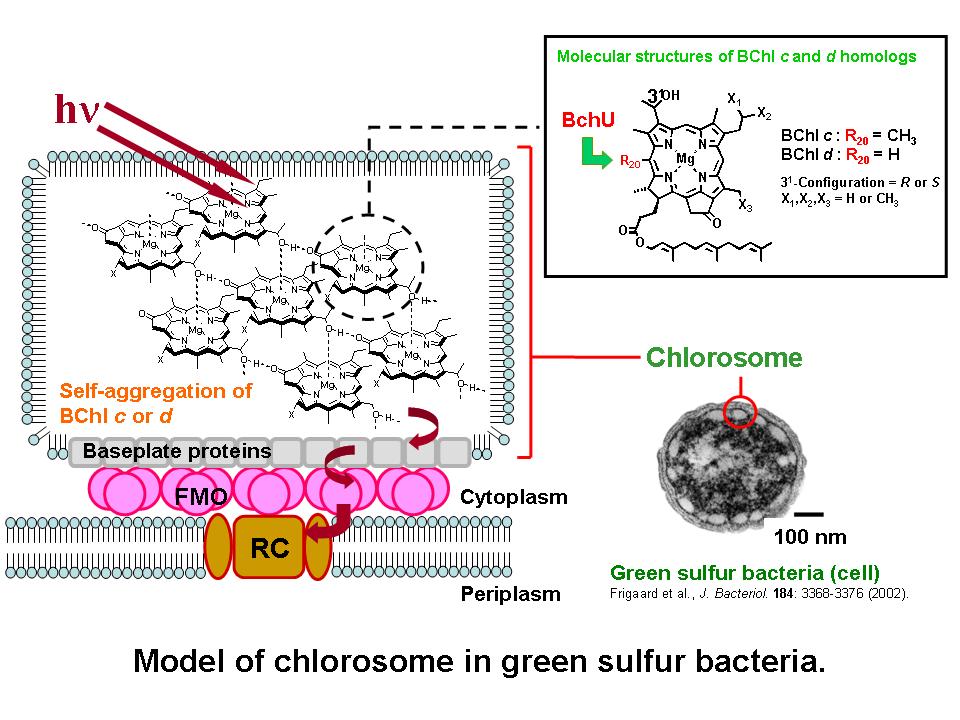
3-2. 緑色イオウ細菌の膜外アンテナ系
緑色イオウ細菌は、クロロソームと呼ばれる特殊な膜外アンテナ系をもつ光合成細菌です。クロロソーム内の光補集部は色素のみからなる自己会合体で、タンパクはその超分子構造の形成において大きな役割を果たしていないことが分かっています。色素は生物種によって異なっていて、バクテリオクロロフィル(BChl)c、d、eのどれかで構成されています。私たちは2002年、Bchl dをもつChlobium vibrioforme野生株からBchl cのみを持つ菌株を単離しました。Bchl dをもつ野生株はもともと20位をメチル化する遺伝子をもっていたにも関わらず、何らかの理由でその発現が抑制されていたものと推測されます。この研究はBchl cおよびBchl dの合成経路に関する遺伝子レベルでの発現・調節の知見を得るために、立命館大学理工学部民秋研究室との共同研究としてスタートしました。メチルトランスフェラーゼはSAMを基質とすることから、酵素化学的にも非常に興味深い反応です。しかも有機化学的には、ポルフィリン環の特定位置にメチル基を導入するということはきわめて困難なことです。この反応メカニズムを解明することにより、有機化学的に有効なメチル化法の工業的応用への展開を目指しています。
3-3. メチル基転移酵素
Bryant(米国)らのグループは分子遺伝学的解析から、bchU遺伝子産物(BchU)がバクテリオクロロフィル(BChl)dをBChl cに変換するC20メチル基転位酵素であることを示しました。しかしながらこの種の分子遺伝学的解析では遺伝子同定を誤る危険性があり、我々は生化学的見地からこのことをin vitro実験系で検証する必要性があると判断しました。そこでBchUの大腸菌での大量発現系を構築し、有機化学的に合成した人工基質(Zn-Bacteriopheophoribide d)を用いてBchUがクロリン環のC20位にSAM依存的にメチル基を付加する反応を触媒することを証明することに成功しました(Harada et al. 2005a)。現在、このC20メチル基転位酵素の反応特性について様々な人工基質を用いて詳細に調べています。この研究は立命館大学理工学部民秋均教授との共同研究であり、有機化学と分子生物学がうまく融合することにより大きく研究が進展させることができた極めてよい事例と自負しています。またBchUの結晶化を試みたところ非常に質のよい結晶標品が得られ(Harada et al. 2005b)、立体構造解析にも成功しました(Wada et al. 2006)。SAM(メチル基ドナー)との共結晶およびバクテリオクロロフィルdとのドッキングシミュレーションから、メチル基転位反応のメカニズムについて考察しました。典型的な二分子求核置換(SN2)反応であることが推測されています。現在、得られた立体構造をもとに、基質結合部位周辺のアミノ酸置換による反応機構の解明に取り組んでいるところです。近い将来、この研究成果についても本ホームページ上で紹介できることを楽しみにしています。
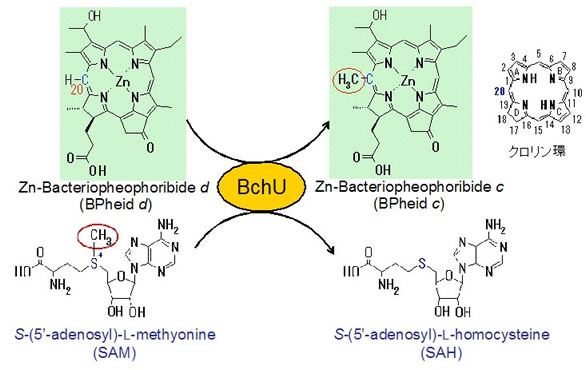
緑色イオウ細菌由来のC20メチル基転位酵素の反応特性
分子遺伝学的解析から、bchU遺伝子産物(BchU)はC20メチル基転位酵素であることが示唆されていた。我々は合成基質を用い、本酵素がクロリン環のC20位にSAM依存的にメチル基を付加する反応を触媒することをin vitroな系で証明した。BchUはバクテリオクロロフィル(BChl)dをBChl cに変換する重要な酵素であることが分かった。
(参考文献)J. Harada, Y. Saga, Y. Yaeda, H. Oh-oka and H. Tamiaki (2005) In vitro activity of C-20 methyltransferase, BchU, involved in bacteriochlorophyll c biosynthetic pathway in green sulfur bacteria. FEBS Lett. 579: 1983-1987
C20メチル基転位酵素BchUの立体構造解析
緑色イオウ細菌由来BchUの立体構造を解析した。SAM(メチル基ドナー)との共結晶およびバクテリオクロロフィルdとのドッキングシミュレーションからメチル基転位反応のメカニズムについて考察した。典型的な二分子求核置換(SN2)反応であることが推測された。
(参考文献)
K. Wada, H. Yamaguchi, J. Harada, K. Niimi, S. Osumi, H. Oh-oka, H. Tamiaki, and K. Fukuyama (2006) Crystal structure of BchU, a methyltransferase involved in bacteriochlorophyll c biosynthesis, and its complex with S-adenosylhomocystein: Implications for reaction mechanism. J. Mol. Biol. 360: 839-849
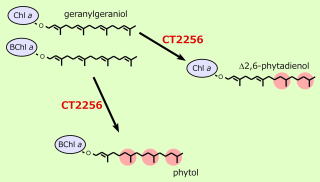
3-4. ゲラニルゲラニル還元酵素
Chl aPDの生合成経路の解析
緑色イオウ細菌の光合成反応中心内で機能する一次電子受容体はクロロフィル色素Chl aPDである。このクロロフィル色素はphytolとは還元状態の異なるΔ2,6-phytadienolをC17位に結合している。前駆体はgenranylgeraniolと考えられ、phytolとΔ2,6-phytadienolがどのような還元過程を経て合成されるかを分子遺伝学的な手法を用いて調べた。その結果、緑色イオウ細菌Chl. tempidumのgeranylgeranyl還元酵素CT2256は、クロロフィル色素の環構造の違いを認識し、BChl aの場合にはphytolを合成し、Chl aに対してはC6=C7部位の二重結合を残したままΔ2,6-phytadienolを合成するのではないかと推測された。
(参考文献)J. Harada, S. Miyago, T. Mizoguchi, C. Azai, K. Inoue, H. Tamiaki, and H. Oh-oka (2008) Accumulation of chlorophyllous pigments esterified with the geranylgeranyl group and photosynthetic competence in the CT2256-deleted mutant of the green sulfur bacterium Chlorobium tepidum . Photochem. Photobiol. Sci. 7: 1179-1187.