新しいウィンドウを開く場合はこちら
目次
- はじめに
- 決定因子による細胞自律的な筋肉分化
- 筋肉決定因子の機能を示す母性mRNAの発見
- macho-1タンパク質の転写因子機能
- 脊索と間充織の誘導
- 内胚葉シグナルに対する応答能の制御
- Directed Signaling and Asymmetoric Divisionモデル
- おわりに
- 文献
はじめに
近年の発生生物学の進歩には目をみはるものがある。それには、古くからの発生学的手法に加え、遺伝学的、分子生物学的手法を駆使して個体発生を解き明かしていこうとする姿勢が重要であった。様々なモデル生物が研究される中で、下等な脊索動物であるホヤもなんとか発生学におけるモデル生物の地位を保ちつつあるように思える1)-4)。
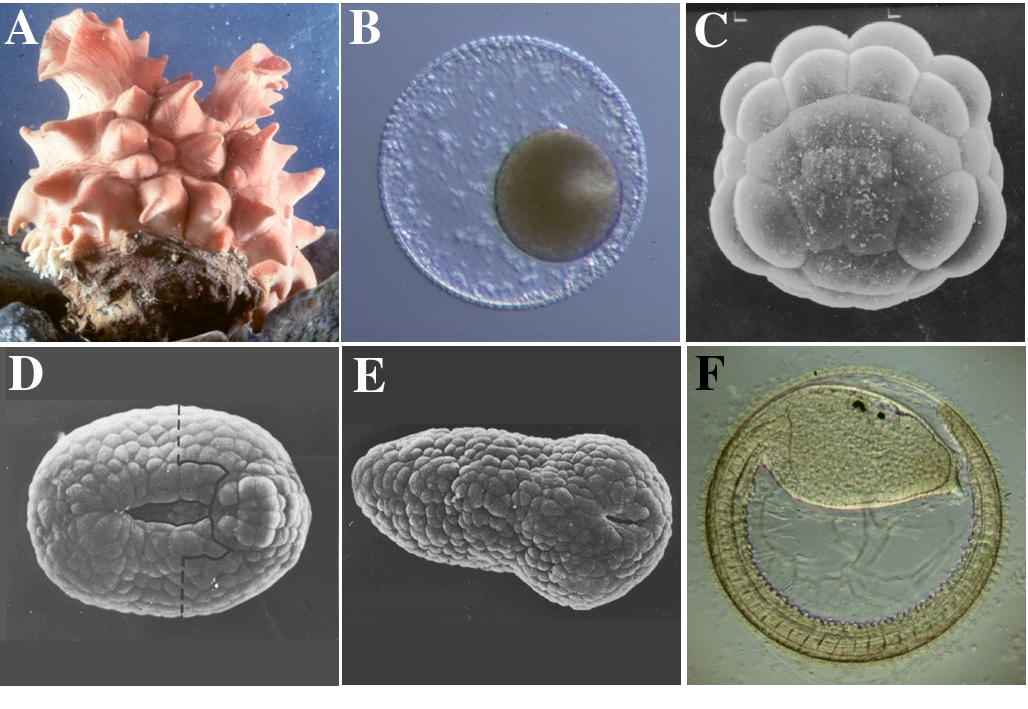
ホヤはモザイク卵の代表として知られ、卵細胞質中で組織決定因子が局在して存在すると考えられていたことから、発生学の研究材料として古くから用いられ、知識の集積があった。また、近年、進化のしくみが再び注目を集めるようになり、我々ヒトを含めた脊索動物共通に見られる基本ボディープランの進化の研究に関して、ホヤが注目を集めるようになっている。また、ホヤの幼生はオタマジャクシ型であるが、胚発生過程は少数の細胞数、および細胞タイプで進行し(図1A-F)、そのシンプルさ故に発生機構の解析が明解に進展している。特に、個体差のない卵割パターンと細胞系譜の詳細な記載がホヤの発生を研究する上での強力なメリットとなっている。近年、ホヤのゲノムプロジェクトが推進され、そのゲノムの小ささ故、来年にもシークエンスが終了すると考えられる。
この総説では、ホヤ胚発生の初期、特に原腸陥入前の卵割期(すなわち1-110細胞期)に起こる胚細胞の発生運命決定機構について、特に中胚葉形成に注目して最近の進歩を概説する。ホヤ胚では、110細胞期までに、ほとんどの割球の発生運命がひとつの組織に限定されており、110細胞期のそれぞれの割球は胚から単離されても、細胞自律的に予定運命どおりの組織分化を遂行することができる。
マボヤの胚発生の仕組みについて
下等脊索動物であるホヤでは、その胚発生の単純さと脊索動物の進化に対する興味から、精力的に研究がおこなわれている。この総説では、特に胚発生における中胚葉パターニングに注目して最近の展開をまとめた。100年来、その存在が予想されていた卵細胞質中の筋肉決定因子がmacho-1として同定された。また、脊索と間充織に関しては誘導的細胞間相互作用が解析され、中胚葉パターニングに関してシンプルなモデルが提唱されている。それには、植物半球後方細胞質因子による割球の応答能の制御と、非対称分裂が深く関わっている。
I. 決定因子による細胞自律的な筋肉分化
ホヤのオタマジャクシ幼生は尾の両側にある筋肉細胞の働きにより海中を泳ぐことができる。この筋肉細胞の数は種によって異なるが、我々の用いているマボヤ(Halocynthia roretzi)の幼生では42個あり、その細胞系譜もすべて明らかにされている5)。初期胚の細胞解離実験や予定筋肉割球の単離実験は、マボヤの筋肉細胞形成の仕組みがその系譜により異なることを示している。すなわち、8細胞期の植物半球後方(B4.1)割球に由来する28個の筋肉細胞は細胞自律的に筋肉に分化したものであるが、植物半球前方(A4.1)割球と動物半球後方(b4.2)割球に由来する尾の先端の14個の筋肉細胞は、原腸胚期の細胞間の相互作用により筋肉へと運命が決定される。前者を一次筋肉細胞、後者を二次筋肉細胞と区別している。
一次筋肉細胞の細胞自律的な筋肉分化の仕組みについては、早くも1905年にConklinがフタスジボヤの胚発生の観察により卵細胞質中に筋肉決定因子の存在を予見していた6)。われわれの研究室では卵細胞質の移植実験を行い、筋肉、表皮、内胚葉の分化に関して、それぞれの決定因子が実際に卵の中で偏って存在していることを実験的に確かめ、その分布を明らかにしてきた(図2A)7)。いわゆるホヤ胚のモザイク性なるものは、これらの決定因子群に負うところが大きいと考えられるが、その実体については最近まで不明であった。

II. 筋肉決定因子の機能を示す母性mRNAの発見
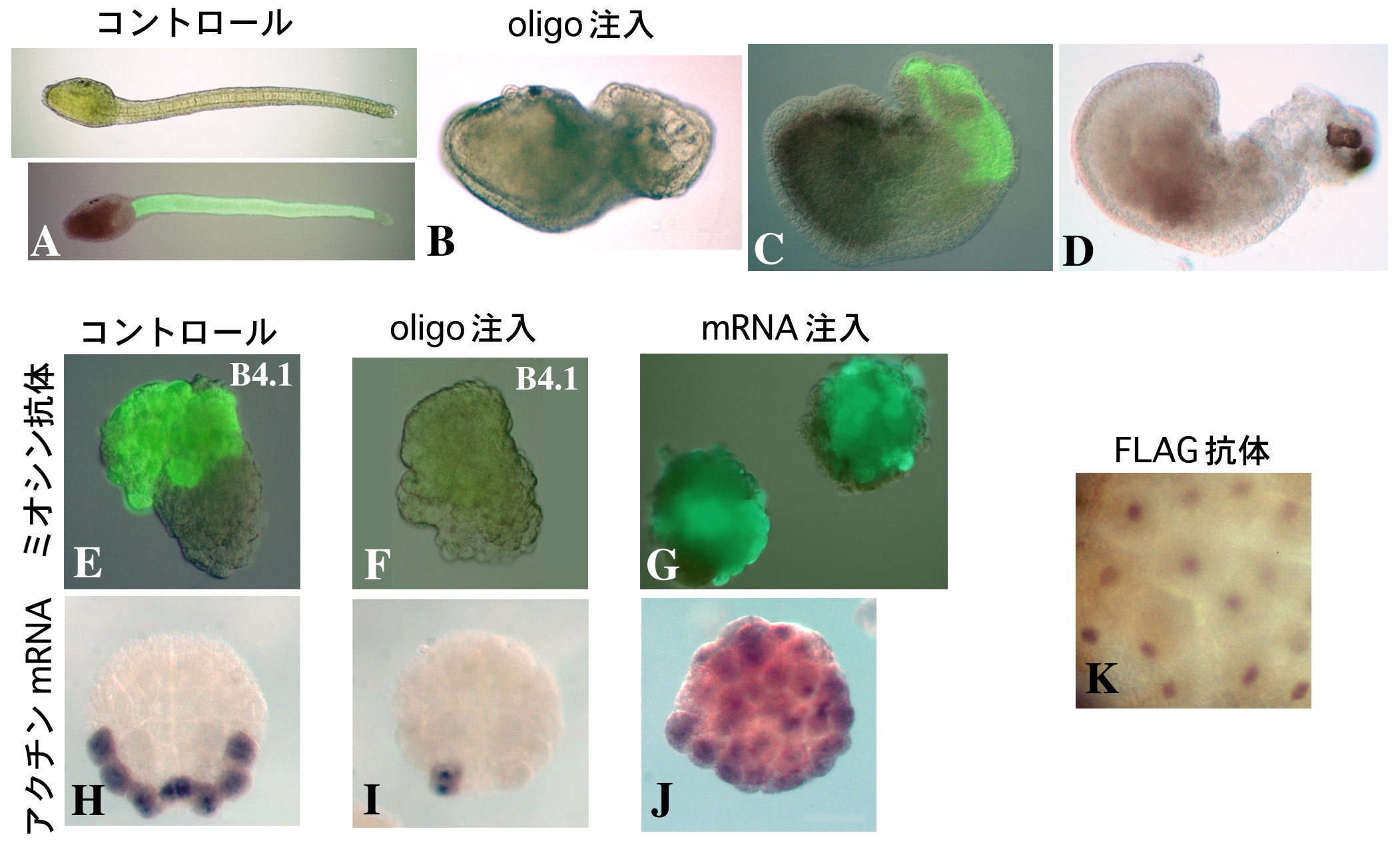
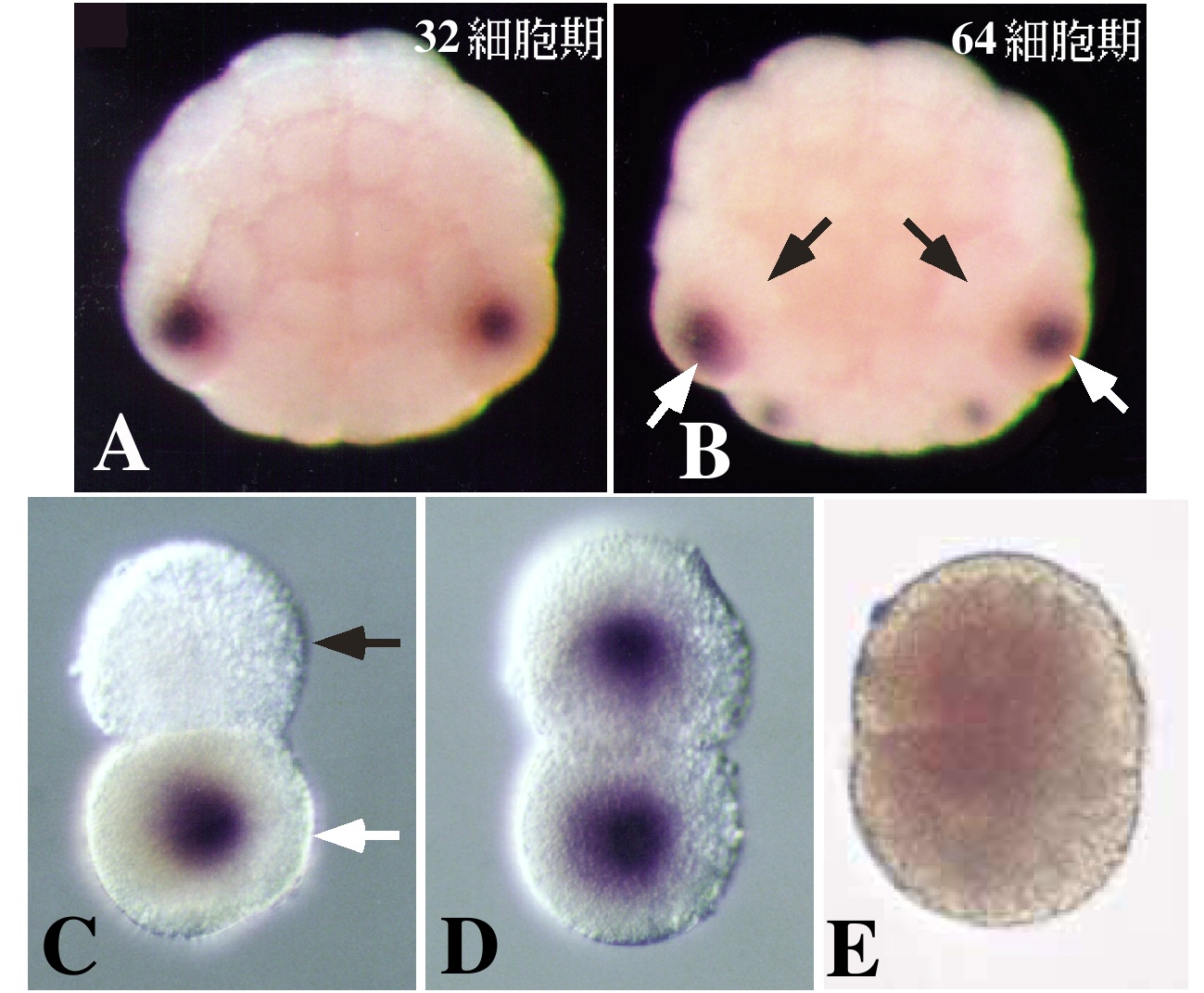
卵細胞質中で局在して存在している筋肉決定因子の分子的実体については、UV照射に対する感受性からRNAがその候補として考えられていた8)。われわれは8細胞期のマボヤ胚からサブトラクション・ハイブリダイゼーション法により胚の植物極側に偏って分布するmRNAのひとつとしてmacho-1(マッチョ1)mRNAを単離した9)。(サブトラクション・ハイブリダイゼーション法とは、発現に時間的・空間的な量差を有する遺伝子を検出する方法のひとつである。比較検体それぞれのmRNAに由来するcDNA間の相補性により検体特異的なcDNAを回収し(サブトラクション)、これを標識プローブとしてcDNAライブラリーのスクリーニングをおこない(ハイブリダイゼーション)遺伝子を同定することができる。)WISH (whole-mount in situ hybridization)による検定では、macho-1の母性mRNAの分布は卵細胞質移植により明らかになっていた筋肉決定因子の分布と良く一致し、zygoticな発現は検出されなかった(図2B)。そこで、このmRNAに対するアンチセンスDNAオリゴ(phosphorothioate oligo)を設計し、未受精卵に注入してmacho-1母性mRNAを除去したのち卵を受精させ、幼生にまで発生させたところ、幼生の尾部の形成異常が観察された(図3A,B)。各種の分化マーカーによる検定で、この異常では筋肉細胞の大部分が欠失していることが示されたが、多くの場合、尾の先端には少数の筋肉細胞が観察され、すべての筋肉細胞が欠失することはほとんどなかった(図3C,D)。正常胚においては、尾の先端部には二次筋肉細胞が存在するので、macho-1母性mRNAの欠失は一次筋肉細胞の形成にのみ効果を及ぼしたと考えられる。このことは、macho-1 mRNA除去胚から予定一次筋肉割球を単離、培養すると筋肉分化能が完全に消失していることで確かめられた(図3E,F)。この単離予定筋肉割球の筋肉分化能は、受精させた macho-1 mRNA除去卵にin vitro合成したmacho-1 mRNAを再び注入することにより回復させることができる。ホヤでは110細胞期に予定一次筋肉割球ですでに筋肉アクチンの遺伝子が発現し始めている(図3H)。macho-1 mRNA除去胚では、このアクチンの発現が抑えられることからも、一次筋肉の欠如が支持された(図3I)。
また、macho-1 mRNAを除去していない正常胚へ合成 macho-1 mRNAを注入して過剰発現させると、通常は筋肉に分化しない割球においても筋肉分化マーカーの発現が検出された(図3G,J)。これらの結果は、macho-1 mRNAの存在がマボヤの一次筋肉細胞の分化に必要であり、また筋肉分化の開始には macho-1 mRNAだけで十分であることを示している。
さらに、macho-1がわれわれの研究室における細胞質移植実験で検出された筋肉決定因子そのものであるかどうかを検定した。macho-1 mRNA除去卵内の本来なら筋肉決定因子が分布する領域の細胞質を、正常胚の予定表皮割球へ移植する実験を行ったところ、正常胚由来の移植片では認められる異所的な筋肉形成能がmacho-1 mRNA除去卵由来の移植片では消失していることが確認された。この結果は、macho-1 mRNAが、局在している筋肉決定因子そのものであることを示している。すなわち、 macho-1は卵に遍在し決定因子からの筋肉分化シグナルを伝達しているような分子ではなく、それ自身が筋肉決定因子であることが示唆された。
III. macho-1タンパク質の転写因子機能
macho-1 mRNAの塩基配列より推測されるタンパク産物は556アミノ酸残基より成るZincフィンガータンパクである。Zincフィンガードメインはタンパクのほぼ中央に位置し、5つのZincフィンガーモチーフを持っている。このZincフィンガードメインのアミノ酸配列は神経分化に関係する転写因子であるGli/Zicファミリー遺伝子のそれと高い相同性を持っていたが、それ以外の領域では特に相同性は見当たらなかった。既にマボヤでも、脊椎動物のZic遺伝子の相同遺伝子と思われる遺伝子(HrZicN)が単離されており、神経特異的な発現様式が報告されているので、Gli/Zicファミリー遺伝子と起源を同じくしながらも、macho-1遺伝子は筋肉決定因子の遺伝子として独立した機能を持つに至ったと考えられる。
Zincフィンガードメインの存在は、macho-1タンパクがDNA結合能を持つことを示唆している。細胞内におけるmacho-1タンパクの分布を、FLAG標識タグ配列を付加したmacho-1 mRNA注入による強制発現で検討したところ、標識タンパクが110細胞期の割球の核に検出され、実際に核タンパクとして存在していることが示された(図3K)。さらに、macho-1タンパクにVP16の転写活性化ドメインあるいは Engrailed の転写抑制化ドメインを付加したものをマボヤ胚で強制発現させ、筋肉関連遺伝子群[筋肉アクチン、ミオシン、Caトランスポーター、AMD1(myogenic factorホモログ)、HrTbx6(Tbx6ホモログ)、Hrsna(snailホモログ)]の発現を調べたところ、すべての筋肉関連遺伝子群の発現が転写活性化/抑制化ドメインの影響下にあることが示された(未発表)。この結果は、macho-1タンパクがこれらの遺伝子群の転写調節に直接あるいは間接に関わっていることを示すものであり、転写因子としての機能を支持するものである。すなわち、局在母性mRNAにコードされている転写因子である macho-1タンパクが筋肉分化カスケードの最上流に位置し、筋肉決定因子として機能している可能性がある。われわれは、このカスケードの全貌を解明することが、ホヤ胚のモザイク的発生研究の大きな課題のひとつであると考えている。
なお、macho-1は、「マボヤのちょーおもしろい遺伝子1」の略称であることを付しておく。ここで紹介した研究は、NatureのNews and Viewsでも紹介されており10)、歴史的いきさつなどに興味がある方は、そちらも参考にされたい。
IV. 脊索と間充織の誘導
ホヤの幼生に存在する主要な中胚葉組織としては、筋肉、脊索、間充織がある。一次筋肉細胞の運命が卵細胞質中の因子により決定されるのに対し、脊索と間充織細胞の運命決定には胚誘導が関係していることがわかっている。表1に、マボヤの脊索・間充織誘導に関して共通に見られる性質を列挙した。これらは、割球の単離および再結合実験等により明らかになったことである。ホヤでは、割球を一つずつ単離して再結合などを行うことにより、誘導を単一細胞レベルで解析できるという利点がある。これらの誘導における誘導因子はFGF(繊維芽細胞増殖因子)であると考えられる。一般に、FGFシグナルはチロシンキナーゼを細胞内ドメインに持つFGFレセプター、Ras, Raf, MEK, MAPKカスケードにより細胞内に伝えられる。ホヤでもまたこのカスケードは保存されている。脊索は脊索動物の共通派生形質なので特によく解析されており、前述の誘導(表1)の結果として、Brachyury遺伝子の発現が64細胞期に活性化され、Brachyury蛋白質は転写因子として様々な脊索特異的遺伝子の発現をその後に引き起こしていくことがわかっている20,21,22)。
さて、図4A-Cには胚内での各割球の位置とその後の発生運命を示してある。ホヤの中胚葉組織は植物半球の周辺領域からできることがわかるだろう。植物極領域には内胚葉割球(黄色)が存在する。胚の前方(図の上方)には神経索(紫)と内胚葉に挟まれる形で、脊索割球(ピンク)がある。胚の後側方には、筋肉(赤)と内胚葉に挟まれる位置に間充織割球(緑)がある。図4D,Eは、脊索と間充織形成に関わる細胞系譜が示してある。胚の前半分には脊索が、後半分には間充織が、よく似た系譜に従って形成されることがわかる。
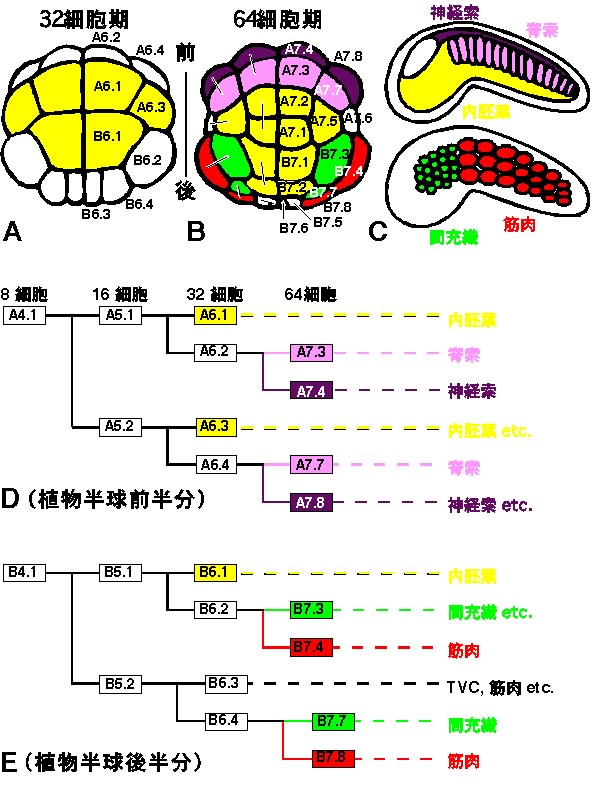
表1を見てもわかるように、脊索と間充織の誘導は多くの共通点を持っている。このことは、胚の前半分と後半分で同じようなしくみが対称的に働いているのではないかということを想像させる。では、よく似た誘導作用により、なぜ脊索もしくは間充織の形成という全く違う結果がもたらされるのであろう。違いは誘導原である内胚葉割球にあるのか、それともシグナルを受け取る側の割球にあるのか?この答えは、前方の内胚葉割球と間充織割球、後方の内胚葉と脊索割球を単離再結合するとわかるはずである。前者の組み合わせでは間充織が、後者の組み合わせでは脊索が形成された。すなわち、誘導原である内胚葉割球はどれも同じで、シグナルを受け取る側の割球がもとから違うのである。このことは、予定脊索や間充織割球をFGF処理することでも支持される。同じFGF処理に対しても、予定脊索割球は脊索に誘導され、決して間充織になることはない。逆もまたしかりである。処理するFGFの濃度には、違いは見られない。すなわち、2種類の割球は同じ誘導シグナルに対する、応答能(responsiveness)が異なっているのである14)。
- 誘導的細胞間相互作用が運命決定に必要である11,12)。
- 誘導は32細胞期に起こる11,12)。
- 64細胞期に予定脊索および予定間充織割球は自律分化能を獲得している11,12)。
- 誘導原は、植物極に位置する内胚葉割球である11,12)。
- FGF処理により誘導を起こすことができるが、Activinには誘導能がない13,14)。
- シグナルの受容能は、32細胞期を過ぎるとすぐに失われる13,14,15)。
- FGFレセプター、Ras、MEKが誘導に必要とされる16,17,18)。
- シグナルを受け取らなかった予定脊索および予定間充織割球は、デフォルトの運命をたどる12,19)。
V. 内胚葉シグナルに対する応答能の制御
では、この応答能の違いは何によってもたらされるのだろうか。論理的に考えられる可能性は、2種類の割球の中身に違いがあるということである。この細胞質中の因子は、卵から受け継いだものである可能性があるので、卵細胞質再配置完了後、第一卵割前の時期(図2参照)に、卵細胞質の移植実験を行った。間充織は植物半球後方から、脊索は植物半球前方から形成されることを思い出して欲しい。そこで、植物半球後方の卵細胞質(PVC)を除去して、PVC除去卵を作った(図5A)。また、PVC卵片を正常卵の前方に移植しPVC移植卵を作った(図5B-D)。PVC除去胚においては、間充織がなくなり、胚の後方にも内胚葉割球を取りまくようにして、脊索割球が異所的に形成された。PVC移植胚では、脊索形成が抑制され、胚の前方からも間充織が形成された14,23)。
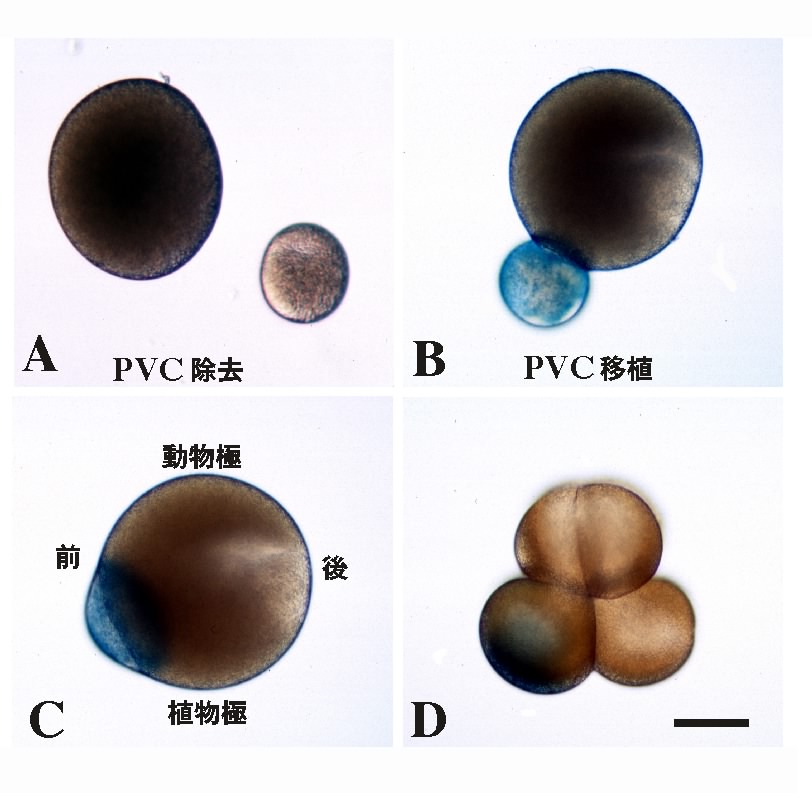
これらの結果を、図6に模式的に示した。各割球の色は、図4と統一してある。同様の実験において、植物半球前方の細胞質の除去および後方への移植を行ったが、これらの胚の発生は至って正常であった。すなわち、取り立てて重要な因子は、胚の前方には局在していないということである。図6に示されるモデルは単純なものであって、PVC因子を受け継いだ割球は、内胚葉からのFGFシグナルを受け取ると間充織へと、PVC因子を受け継いでいない割球は同じシグナルにより脊索へと誘導される。
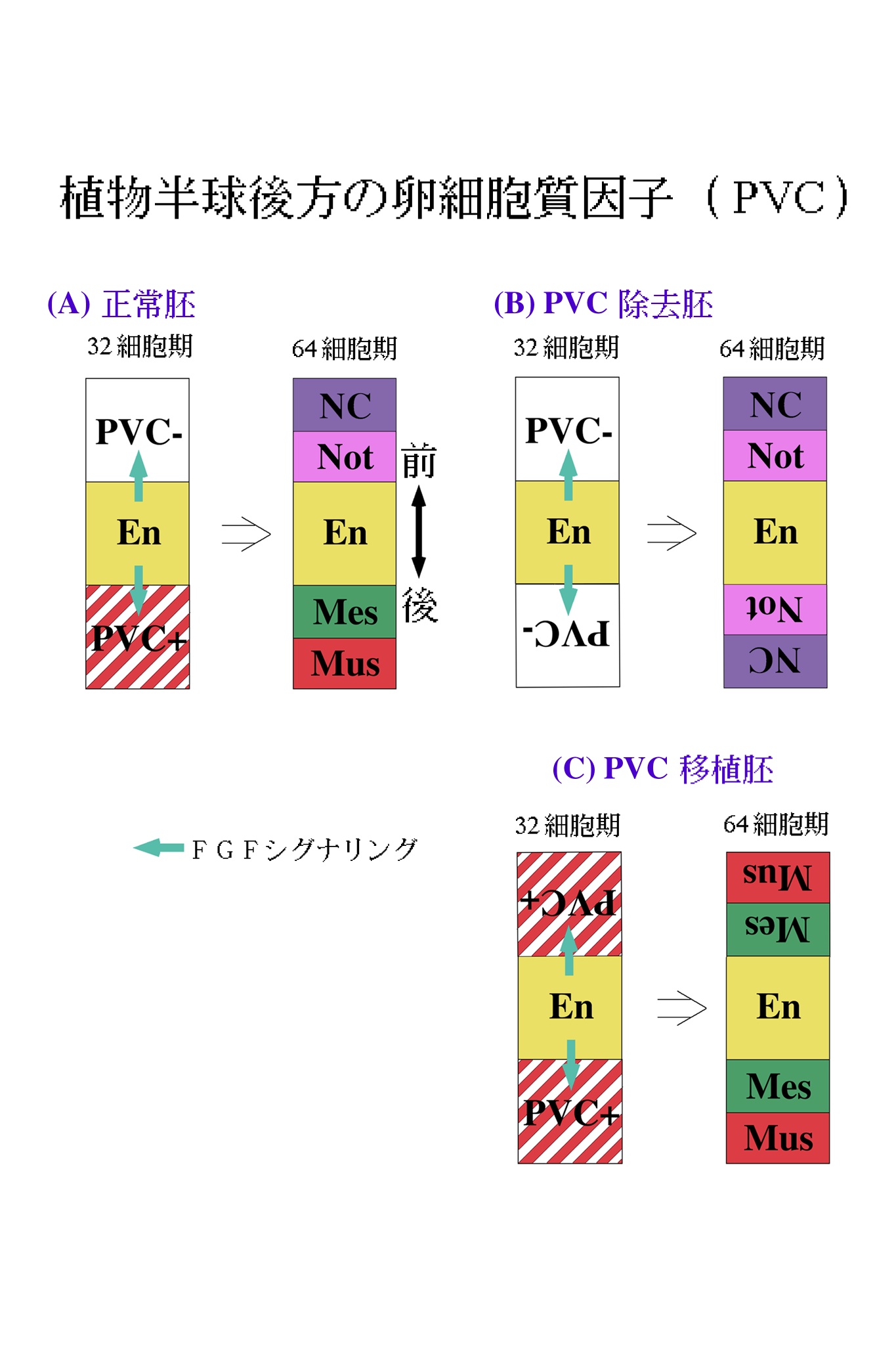
このように、ホヤ胚における中胚葉パターニングは、脊椎動物におけるものと違う原理に基づいているようだ。BMPシグナリングのアンタゴニズムに見られるような、シグナリング活性の勾配によるパターニングは採用しておらず、もっとデジタルな運命決定法を用いているように見える。さて、PVC因子の実体は何であろうか。PVCはmacho-1母性mRNAが局在している領域と重なっている (図2B、右の図)。現在、macho-1がPVC因子そのものであるかどうかを検討しているところである。
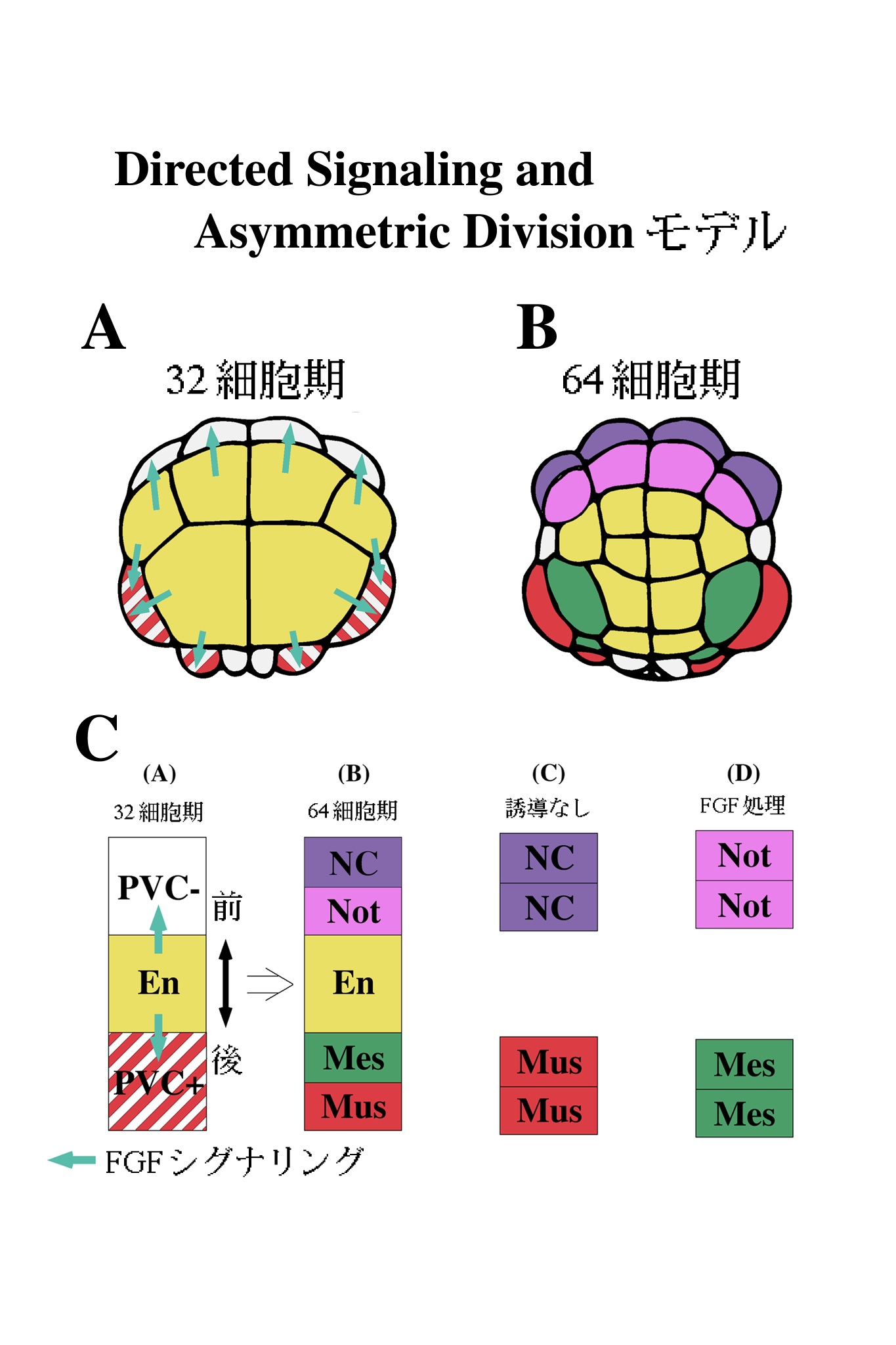
VI. Directed Signaling and Asymmetoric Divisionモデル
間充織と脊索誘導の解析から、もうひとつのおもしろい特徴が浮かび上がってきた。よく考えると、これらの誘導にはおかしな所がある。自律分化能獲得のステージ、時期をずらした割球再結合実験、FGF処理に対する感受性期、さらにシグナリングの阻害剤に対する感受性期、すべての結果は誘導が主として32細胞期に起こっていることを示している11-15,18)。しかし、32細胞期では割球の発生運命が未だ一つの組織に限定されていない。図4A,Bにあるように、例えば32細胞期のA6.2という割球は、次の分裂で前後に分裂し脊索割球と神経索割球を生み出す。同様に、胚の後方では、32細胞期のB6.2という割球が分裂し間充織割球と筋肉割球を生み出す。このことは、図4D,Eの細胞系譜図からもわかる。すなわち、32細胞期に誘導が起こった結果、次の分裂でできる二つの娘細胞のうち片方だけが、脊索、間充織の運命をたどるのである。また、常に内胚葉に面している娘細胞のみが誘導された運命をたどることがわかる。これは脊椎動物などで見られるような、多くの細胞が一挙に誘導され、一団となって誘導された運命をたどるという現象とは印象を画する。
図7は、32細胞期から64細胞期にかけてのアクチン遺伝子の発現を見たものである。32細胞期になるとまだ割球の運命が筋肉に限定されていないにも関わらず、B6.2という間充織/筋肉前駆割球でアクチンの発現が始まる。しかし、次の分裂が起こり64細胞期になると間充織割球(黒矢印)での発現は消え、筋肉割球(白矢印)のみで発現が続く24)。図7Cは、Bで示した黒矢印と白矢印の割球を胚から単離し、すぐにアクチンの発現を見たものである。しかし、間充織/筋肉前駆割球を32細胞期初期に胚から単離し内胚葉との接触を断った後、一度だけ分裂させアクチンの発現を見ると、両方の娘細胞で発現が維持されてしまうことがわかる(図7D)。すなわち、32細胞期に受け取った内胚葉シグナルは、すぐに間充織割球におけるアクチン遺伝子の発現抑制という形で現れることがわかる。図7Dの二つの娘細胞は、このあと両方とも実際に筋肉細胞へと分化してしまい、間充織は形成されないことがわかっている。さらに32細胞期初期に単離した割球をすぐFGF入りの海水につけこみ全方向から処理を行うと、両方の娘細胞でアクチンの発現が抑えられるとともに(図7E)、両者は、間充織細胞へと分化することがわかっている12,14)。このシステムでは、デフォルトの運命が筋肉であり、誘導された運命が間充織であることがわかる。ちなみに、間充織割球も誘導がないと筋肉になれることから、間充織割球にもmacho-1蛋白質が分布していると推測され、PVC因子がmacho-1蛋白質である可能性を高めている。macho-1の筋肉形成活性は、FGFシグナリングにより間充織割球の中では抑制されるか修飾されるのだろう。
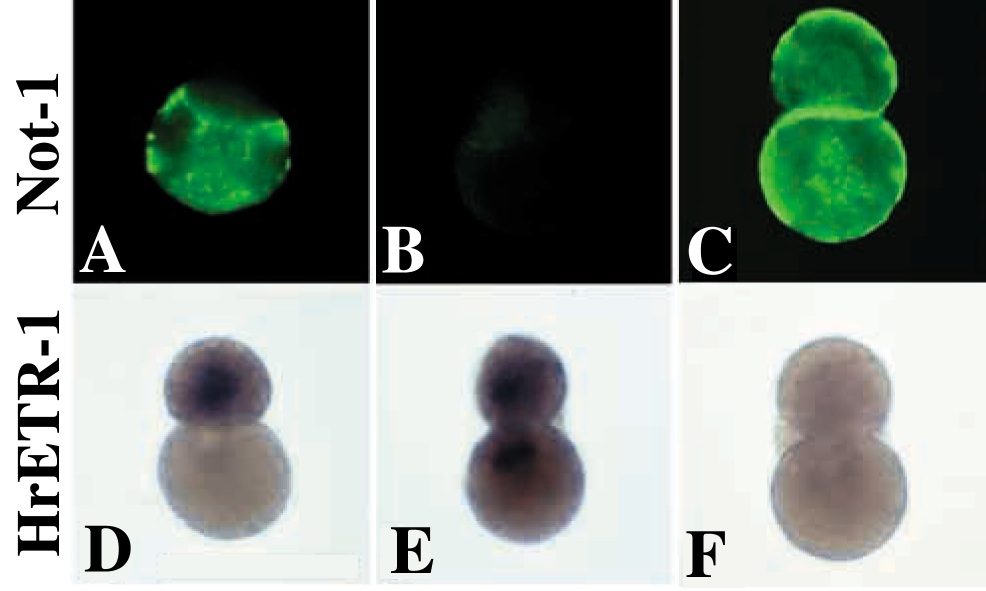
同様のことが、胚前方でも起こっている。誘導が完了したあとの64細胞期に脊索割球と神経索割球を単離し、その後の細胞分裂を抑制した後、分化マーカーの発現を見ると、それぞれの割球は予定運命どおりに分化することがわかる(図8A,D)。しかし、32細胞期初期に脊索/神経索前駆割球を単離すると、両娘細胞とも神経板マーカーであるHrETR-1を発現してしまい、脊索分化は見られない(図8B,E)。反対に単離割球をFGF海水で処理すると、両娘細胞とも脊索マーカーであるNot-1を発現してしまい、神経索分化は見られない(図8C,F)19)。胚の前方では、デフォルトの運命が神経索であり、誘導された運命が脊索であることがわかる。ちなみにここで神経索と呼んでいる構造は、主としてオタマジャクシ幼生の尾の部分に存在する神経管のことである (図4C)。たとえ尾の部分であるとしても神経管細胞が誘導なしに分化できるというのは意外だ。しかしこのことは、様々な方法、様々なマーカーを用いて確認されており確かである。ただ、分化マーカーの発現が自律的に起こるからといって、神経管形成の形態形成運動に細胞間相互作用がいらないとまでは言い切れない。また、幼生の頭部にある前方の神経管は脳と呼ばれており、動物半球に由来するその形成には、確かに誘導がいることがわかっている。
以上の結果をモデルとして図9にまとめた。我々は、このモデルをDirected Signaling and Asymmetric Division モデルと呼んでいる4,19)。32細胞期に内胚葉から発せられたFGF(Directed Signaling)は、次の分裂にさいし胚前方と後方で非対称分裂(Asymmetric Division)をひきおこす(図9A,B)。図9Cは、それをさらに模式化したものであるが、内胚葉シグナルを受け取った割球はPVCの存在・不在に依存して、内胚葉に面した側にそれぞれ間充織もしくは脊索を生み出す。内胚葉から遠い方の娘細胞はデフォルトの運命である筋肉と、神経索の運命をたどる。誘導シグナルを受け取る方向が重要であることの証拠は、FGF処理を全方向から行った場合に両方の娘細胞が、誘導された運命をたどってしまうことから推測される。おそらく内胚葉からのシグナルは、32細胞期の親細胞を極性化するのではないだろうか。FGFを細胞の片側から受け取ることにより、局部的な変化が親細胞内で起こることが考えられる。現在、FGFシグナリングカスケードの下流の細胞質因子が細胞内で、局部的に活性化されているかどうかを検討中である。
おわりに
筋肉決定因子としてのmacho-1の同定は、ホヤにおいて100年来予想されていた卵細胞質内に局在して存在する因子の存在を、実際に目の当たりに見せてくれた。ショウジョウバエやカエルの卵でも、胚発生に重要な役割を果たす局在母性mRNAが数多く見つかっている。このような因子の多くのものが蛋白質としてではなくmRNAとして見つかるということが一般的なように思えるが、それはRNAが実験的に扱いやすいという理由によるものなのか、それとも実際に局在因子はRNAである場合が多いのかは気になるところである。
脊索・間充織誘導の解析からは多くのことがわかった。そしてできあがったモデルは、大変シンプルなものである。ホヤは、脊椎動物の初期誘導とはいくつかの面でかなり違ったしくみを用いているように見える。このようなしくみをとっているのは、胚を構成する細胞数の少なさと関係しているのだろう。しかし、同様の現象はホヤに限らず、様々な動物の発生において、いろいろな部分で見られるに違いない。細胞間相互作用においては、細胞内の因子が応答能を制御し、細胞外からのシグナルの有無が最終的な細胞運命を決定するだろう。ホヤに限らず、また胚の細胞数が多くなってからでも、非対称分裂は細胞の多様性を増加させる為に様々な局面で利用されているに違いない。