研究計画
(I) ショウジョウバエにおける左右非対称性の形成機構
外見が左右対称な動物においても、内臓器官は左右非対称な場合が多い。このような左右性形成の形成機構については、脊椎動物の一部ではよく理解されている。しかし、左右非対称性の形成機構が進化的に多様性であることが明らかにされつつあり、脊椎動物とは異なった左右非対称性の形成機構の存在が予測されている。松野研究室では、左右非対称性形成の新規な機構を明らかにすることを目的として、分子遺伝学のモデル動物であるショウジョウバエの消化管にみられる、ステレオタイプな左右非対称性に注目している。これまでも、ショウジョウバエの左右非対称性形成で働く遺伝子を同定し、左右非対称性が形成される機構を明らかにしてきた。これまでの研究で、消化管の左右非対称な変形が、細胞形態の左右非対称な歪みによって起こっていることが示唆できた。この左右非対称な細胞形態は、鏡像が元の形と重ならないことから、キラルである。我々は、この現象を平面内細胞キラリティと呼ぶことにした。今後、平面内細胞キラリティが形成される機構についての解析を進めて行く。
松野研究室では、消化管の左右非対称な形態が、消化管が平面内細胞キラリティによって発生した「力」で形成されると考えている。このとき発生している「力」の測定に成功しており、「力」と遺伝子機能の関連を定量的に解析することで、細胞レベルの事象と生物力学を結び付けることが可能になると考えている。
左右非対称性形成の遺伝的経路の解明
ショウジョウバエ胚消化管は前腸、中腸、後腸の3つの部位から構成されており、さらに、中腸は4つのチャンバーに分かれています。それぞれが明瞭な左右非対称性を示し、野生型胚の消化管を観察しても逆位を示す胚がほとんど現れないことから、ショウジョウバエ胚消化管の左右非対称性は遺伝的に決定されていると考えられます。これまでに松野研究室では、ショウジョウバエ胚消化管の左右非対称性形成に関与する複数の責任遺伝子を同定しています。興味深いことに、これらの責任遺伝子は、大きく二つのグループに分類されました。一つは、消化管の前方部の左右非対称性形成に関与するグループ。そしてもう一つは、消化管の後方部の左右非対称性形成に関与するグループです。
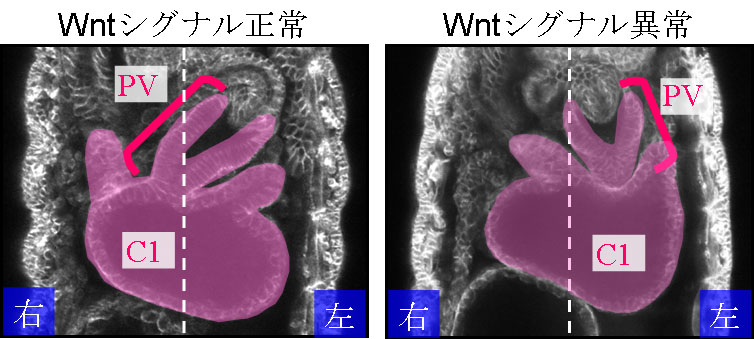
ショウジョウバエの野生型胚では、腹側から見て前腸は大きく右側にループしており、左側に傾いた前胃(PV)と呼ばれる部位が中腸の第一チャンバー(C1)の右側に連結しています。この前腸、前胃、そして中腸第一チャンバーから成る消化管の前方部は図のように明瞭な左右非対称性を示しています。これまでに松野研究室では、この消化管の前方部の左右非対称性にWntシグナルが重要な役割を果たしていることを明らかとしています(Kuroda et al., 2012)。Wntシグナルはヒトからショウジョウバエ、線虫まで進化的に広く保存された細胞シグナル伝達経路であり、発生過程において、細胞増殖、細胞分化、細胞極性など多岐にわたった機能を果たしていることで知られています。WntシグナルのリガンドであるWnt4や、レセプターをコードするfrizzled2、補助レセプターをコードするarrowの突然変異体胚では、消化管前方部の左右非対称性がランダム化していました。一方、これらの突然変異体胚では、消化管後方部の左右非対称性はほぼ正常でした。
また、松野研究室の研究によって、消化管前方部の正常な左右非対称性が形成されるためには、中腸の環状筋細胞においてWntシグナルの古典的経路が活性化されることが必要であることが明らかとされました。野生型胚では、消化管前方部の左右非対称性が形成される前のステージでは、中腸の環状筋細胞は、正中線にほぼ垂直に配列しています。しかし、 消化管前方部の左右非対称性が形成されるのに先立って、中腸の右側の環状筋細胞が正中線に対して傾き、この環状筋細胞の再編成によって前胃と中腸第一チャンバーの連結部が右側に引っ張られるようにして移動することで正常な左右非対称性が形成されます。Wnt4の突然変異体胚を観察したところ、この左右非対称な中腸環状筋細胞の再編成が異常となっていました。このことから、Wnt4は中腸環状筋細胞の左右非対称な再編成に重要な役割を果たしていることが示唆されました。
また、これまでの松野研究室の研究から、消化管前方部の左右非対称性の形成には、JNKシグナルや、MyosinⅡが関与することが明らかとされています(Taniguchi et al., 2007; Okumura et al., 2010)。JNKシグナルが内臓筋で亢進している胚では、消化管前方部の左右非対称性がランダム化し、またWnt4突然変異体胚と同様に、左右非対称な中腸環状筋細胞の再編成が異常となっていました。一方、MyosinⅡ突然変異体胚では、野生型胚でみられるような前胃と中腸前半部の連結部の移動は起こらず、これによって消化管前方部は左右対称化していました。また、MyosinⅡ突然変異体胚は、中腸の左右の環状筋細胞がどちらもほぼ傾かなくなる異常を示していました。
また、これまでの松野研究室の研究から、消化管前方部の左右非対称性の形成には、JNKシグナルや、MyosinⅡが関与することが明らかとされています(Taniguchi et al., 2007; Okumura et al., 2010)。JNKシグナルが内臓筋で亢進している胚では、消化管前方部の左右非対称性がランダム化し、またWnt4突然変異体胚と同様に、左右非対称な中腸環状筋細胞の再編成が異常となっていました。一方、MyosinⅡ突然変異体胚では、野生型胚でみられるような前胃と中腸前半部の連結部の移動は起こらず、これによって消化管前方部は左右対称化していました。また、MyosinⅡ突然変異体胚は、中腸の左右の環状筋細胞がどちらもほぼ傾かなくなる異常を示していました。
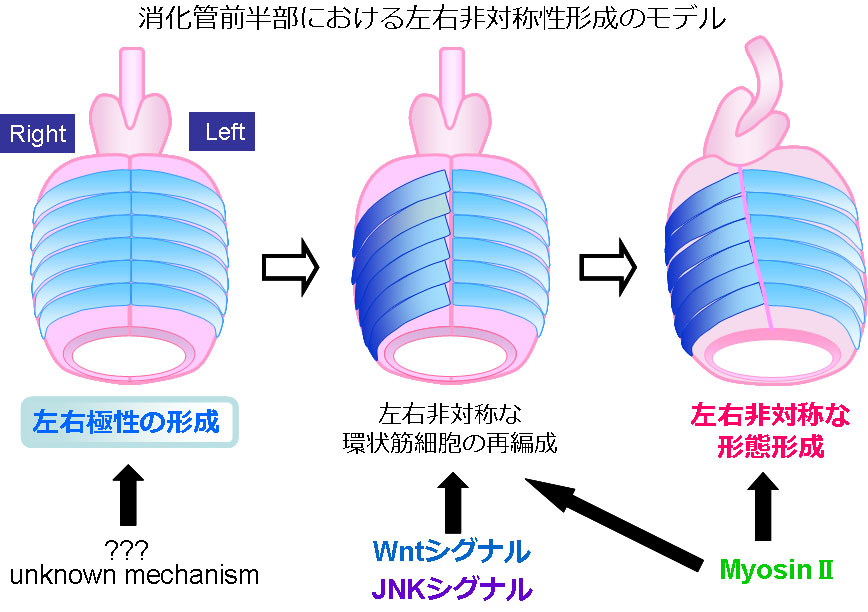
これまでの松野研究室の研究の結果から、ショウジョウバエ胚の消化管前方部の左右非対称性は、以下のようなメカニズムによって形成されると考えられています。まず、未知の因子によって、中腸環状筋細胞に左右極性が形成されます。次に、WntシグナルとJNKシグナルが活性化することによって環状筋細胞の左右非対称な再編成が引き起こされ、MyosinⅡによって環状筋細胞内に物理的な力が発生し、最終的に消化管前方部の形態が左右非対称となります。
これに対して、ショウジョウバエ胚消化管の後方部の左右非対称性には、Myosin31DFやE-Cadherin、pebbleなどが関与することが明らかとされています。ショウジョウバエ胚消化管の後方部に位置する後腸は、背側から見て大きく右側に屈曲しており、明瞭な左右非対称性を示します。しかし、Myosin31DFの突然変異体胚では、後腸は野生型とは反対の左方向に屈曲し、鏡に写したような構造をとっています。このことから、後腸の左右非対称性には、Myosin31DFが重要な役割を果たしていることが明らかとされました(Hozumi et al., 2006)。後腸は、始め左右対称な形態をしていますが、これが反時計回りに稔転することで左右非対称な形態へと変化します。この左右非対称な稔転運動の機構を明らかとするために、後腸上皮細胞の形状を注意深く観察してみると、稔転が起こる前は、後腸管内面側の細胞形状が左右に歪んでいますが、稔転が起こった後はその細胞の形状は左右対称と変化することがわかりました (Taniguchi and Maeda et al.,2011)。さらに、Myosin31DFの突然変異体胚では、稔転が起こる前の上皮細胞の左右非対称な形状が野生型とは逆転していることが明らかとなりました(Taniguchi and Maeda et al.,2011)。
また、RhoGEFをコードするpebbleの突然変異体胚では、後腸の左右非対称性がランダム化しており、このとき、後腸上皮の細胞数は野生型胚と比較すると減少していました。このことから、後腸の左右非対称性には、Pebbleによる後腸上皮の正常な細胞分裂の制御が必要であることが示唆されました(Nakamura et al., 2012)。
松野研究室では、現在ショウジョウバエ胚消化管の左右非対称性形成に関与する遺伝子の遺伝的な相互作用の解明に取り組んでおり、また、新たな責任遺伝子の同定も試みられています。今後の研究によって、消化管などの内臓器官が左右非対称に配置されたり、複雑に折れ曲がる分子メカニズムが明らかとされることが期待されます。
これに対して、ショウジョウバエ胚消化管の後方部の左右非対称性には、Myosin31DFやE-Cadherin、pebbleなどが関与することが明らかとされています。ショウジョウバエ胚消化管の後方部に位置する後腸は、背側から見て大きく右側に屈曲しており、明瞭な左右非対称性を示します。しかし、Myosin31DFの突然変異体胚では、後腸は野生型とは反対の左方向に屈曲し、鏡に写したような構造をとっています。このことから、後腸の左右非対称性には、Myosin31DFが重要な役割を果たしていることが明らかとされました(Hozumi et al., 2006)。後腸は、始め左右対称な形態をしていますが、これが反時計回りに稔転することで左右非対称な形態へと変化します。この左右非対称な稔転運動の機構を明らかとするために、後腸上皮細胞の形状を注意深く観察してみると、稔転が起こる前は、後腸管内面側の細胞形状が左右に歪んでいますが、稔転が起こった後はその細胞の形状は左右対称と変化することがわかりました (Taniguchi and Maeda et al.,2011)。さらに、Myosin31DFの突然変異体胚では、稔転が起こる前の上皮細胞の左右非対称な形状が野生型とは逆転していることが明らかとなりました(Taniguchi and Maeda et al.,2011)。
また、RhoGEFをコードするpebbleの突然変異体胚では、後腸の左右非対称性がランダム化しており、このとき、後腸上皮の細胞数は野生型胚と比較すると減少していました。このことから、後腸の左右非対称性には、Pebbleによる後腸上皮の正常な細胞分裂の制御が必要であることが示唆されました(Nakamura et al., 2012)。
松野研究室では、現在ショウジョウバエ胚消化管の左右非対称性形成に関与する遺伝子の遺伝的な相互作用の解明に取り組んでおり、また、新たな責任遺伝子の同定も試みられています。今後の研究によって、消化管などの内臓器官が左右非対称に配置されたり、複雑に折れ曲がる分子メカニズムが明らかとされることが期待されます。
平面内細胞キラリティー
多くの高等動物は、体の形態やその機能に左右非対称性を示します。ショウジョウバエの発生過程において、最も初期に左右非対称性を示すのは胚消化管です。ショウジョウバエ胚では、前腸、中腸、後腸において左右非対称性が観察される。
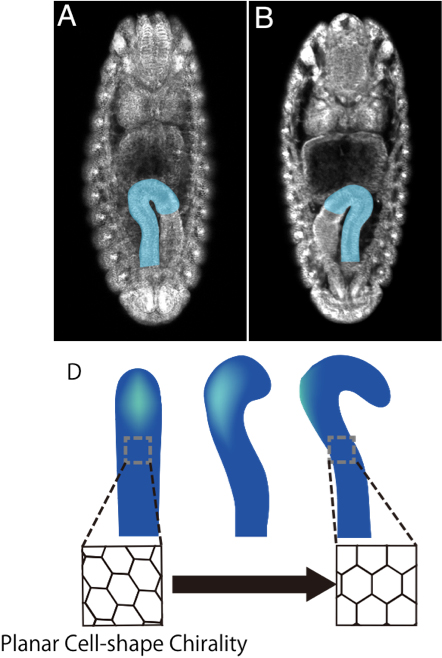
これらの中でも後腸は、構造が単純で、形態変化がダイナミックであるため、左右非対称性形成を研究するのに良いモデルです(図1A)。ショウジョウバエ胚後腸は発生の早いステージでは左右対称な形態を示します。その後の発生段階において、 後腸は後方から見反時計回りにて90度回転する(図1D)。野生型の胚のほぼ全てが反時計回りに90度回転することから、この回転方向と角度は遺伝的に決定されていることがわかります。
左右非対称性形成に関与する遺伝子を同定するため、当研究室では、ショウジョウバエ胚消化管の左右非対称生異常を指標とした遺伝的スクリーンが行われてきました。その結果、後腸の左右非対称性が逆転するMyosin31DF(Myo31DF)突然変異体が同定されました(図1B)。Myo31DFは、I型非定型ミオシンをコードしている。Myo31DFがどのように後腸の左右非対称性形成に関与しているかを明らかとするために、後腸の90度反時計回転に伴う後腸上皮細胞の形態変化の詳細な観察を行いました。その結果、後腸が左右対称なステージにおいて、上皮細胞が細胞レベルのキラリティー(鏡像が、もとの像と重ならない性質)を示すことを明らかにしました(図1D)。つまり、後腸の管の内面側にあたる上皮細胞の形態に左右のゆがみがあることがわかりました。この細胞レベルのキラリティーを、 Planar Cell Chirality (PCC)と名づけました。さらに、後腸の回転後、PCCの左右バイアスは左右対称化することがわかりました。つまり、このことは、後腸の回転中に細胞形状が変化し、左右対称な形態をとるようになることを示唆している。さらに、この細胞形態の変化が、後腸の回転を誘発するのに十分であることを、コンピュータ・シミュレーションを用いて示しました。野生型のPCCを測定した方法で、Myo31DF突然変異体のPCCを測定したところ、Myo31DF突然変異体の後腸上皮では、PCCの左右バイアスが逆転していることがわかりました。 最近になって、このような細胞レベルのキラリティーが、哺乳類の培養細胞にも存在することがわかってきました。
左右非対称性形成に関与する遺伝子を同定するため、当研究室では、ショウジョウバエ胚消化管の左右非対称生異常を指標とした遺伝的スクリーンが行われてきました。その結果、後腸の左右非対称性が逆転するMyosin31DF(Myo31DF)突然変異体が同定されました(図1B)。Myo31DFは、I型非定型ミオシンをコードしている。Myo31DFがどのように後腸の左右非対称性形成に関与しているかを明らかとするために、後腸の90度反時計回転に伴う後腸上皮細胞の形態変化の詳細な観察を行いました。その結果、後腸が左右対称なステージにおいて、上皮細胞が細胞レベルのキラリティー(鏡像が、もとの像と重ならない性質)を示すことを明らかにしました(図1D)。つまり、後腸の管の内面側にあたる上皮細胞の形態に左右のゆがみがあることがわかりました。この細胞レベルのキラリティーを、 Planar Cell Chirality (PCC)と名づけました。さらに、後腸の回転後、PCCの左右バイアスは左右対称化することがわかりました。つまり、このことは、後腸の回転中に細胞形状が変化し、左右対称な形態をとるようになることを示唆している。さらに、この細胞形態の変化が、後腸の回転を誘発するのに十分であることを、コンピュータ・シミュレーションを用いて示しました。野生型のPCCを測定した方法で、Myo31DF突然変異体のPCCを測定したところ、Myo31DF突然変異体の後腸上皮では、PCCの左右バイアスが逆転していることがわかりました。 最近になって、このような細胞レベルのキラリティーが、哺乳類の培養細胞にも存在することがわかってきました。
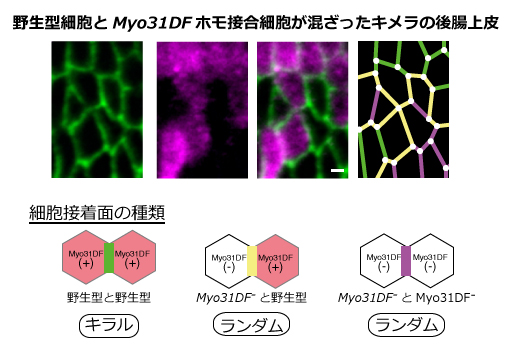
PCCが形成される機構を明らかにするために、PCC形成の細胞自律性について調べています。異なるPCCを持つ野生型とMyo31DFホモ接合細胞から成るモザイク後腸上皮をつくることで、PCCが個々の細胞ごとに形成されるかどうかを調べることができると考えました。このモザイク胚において、野生型細胞とMyo31DF接合細胞におけるPCCをそれぞれ測定しました。(図2)その結果、野生型細胞内の細胞辺は、野生型のPCCを示した。しかし、Myo31DFホモ接合細胞どうしの細胞辺のPCCはランダム化していました。つまり、周りの細胞のPCCとは無関係にクローン内のPCCが形成されており、このことは、PCCは細胞自律的に形成されることになります。
今後の計画
今後の計画
- PCC形成の細胞自律的な現象を再現できる上皮細胞のコンピュータ・モデルを構築し、PCCの形成を説明できる各細胞辺の張力や、収縮のパラメーターを決定していく。
- 細胞のレーザーを用いた細胞辺切断実験により、生体内の後腸上皮の細胞辺にかかる収縮力の測定を行なう。
- 4Dイメージングを行い、後腸の捻転に伴う細胞レベルの変化を観察する。
左右非対称性形成のメカノバイオロジー
 図1 Stokesの式を模式的に示した図。レイノルズ数が非常に低い条件において、Stokesの式より球体が受ける「力」を定量化できる。
図1 Stokesの式を模式的に示した図。レイノルズ数が非常に低い条件において、Stokesの式より球体が受ける「力」を定量化できる。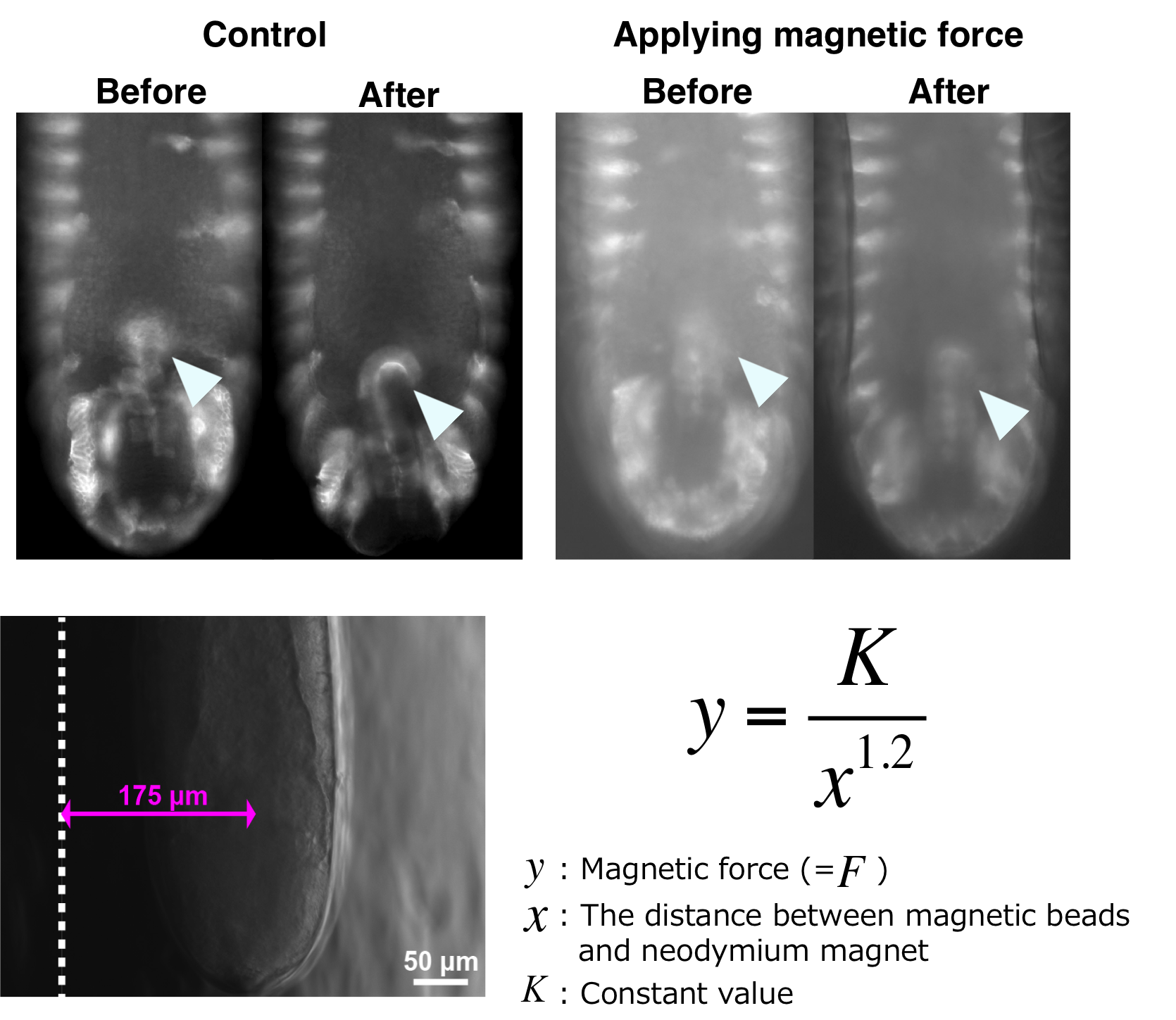 図2 顕微注入した磁性ビーズに磁力を加えることで、後腸の捻転を止める実験の写真。上段4枚の写真の中で、矢頭の部分が後腸。後腸は、傘の柄のような形態をしており、捻転前には、先端部が画面の向こう側に伸びた状態になっている(トピックス欄参照)。左のコントロールでは、先端部が左から右に捻れている(上段左)。磁力をかけた時には、その先端部が画面の向こう側に向いたままである(上段右)。下段左は、磁石と後腸内腔との距離を測定している写真。下段右は、磁性ビーズと磁石との間の磁力とそれらの距離の関係を示す式。
図2 顕微注入した磁性ビーズに磁力を加えることで、後腸の捻転を止める実験の写真。上段4枚の写真の中で、矢頭の部分が後腸。後腸は、傘の柄のような形態をしており、捻転前には、先端部が画面の向こう側に伸びた状態になっている(トピックス欄参照)。左のコントロールでは、先端部が左から右に捻れている(上段左)。磁力をかけた時には、その先端部が画面の向こう側に向いたままである(上段右)。下段左は、磁石と後腸内腔との距離を測定している写真。下段右は、磁性ビーズと磁石との間の磁力とそれらの距離の関係を示す式。
松野研究室では、組織内の細胞レベルの現象と「力」を結びつけたいと考えている。このためには、「力」を定量的に扱う必要がある。そこで、松野研究室では、組織が生み出す「力」を測定する新しい方法を開発した。注目しているのは、ショウジョウバエ胚の消化管が左右非対称になる際に起こる、消化管の左ネジ方向の捻転である。この手法では、磁気ビーズを消化管内に顕微注入し、磁石を近づけることで、後腸の捻転に必要な「力」と釣り合う「力」を発生させる。捻転に必要な「力」と釣り合う磁力により、消化管の捻転を人為的に止め、その時加えた「力」と回転軸からの距離より捻転に必要なトルクを算出する。具体的な方法は、以下の通りである。
- 磁気ビーズと磁石の間に働く「力」を定量化する。粘度標準液(あらかじめ粘度が明らかとなっているシリコンオイル)内で丸く固めた磁気ビーズを磁石で引っぱり、その時の磁性ビーズの大きさと速度を測定する。これらの値と粘度標準液の粘度から、“ストークスの式”を用いることで磁性ビーズが受けている「力」を算出できる(図1)。このとき、磁性ビーズの量によって磁石から受ける「力」が変わるため、磁性ビーズの量と「力」の大きさの関係を明らかにしておく。また、磁性ビーズと磁石の間の距離によっても、その「力」の大きさが変わるため、距離と「力」の関係を調べる。
- ショウジョウバエの後腸が、左ネジ方向に90度捻転する。磁気ビーズを捻転前の後腸内腔に顕微注入する。このとき、蛍光ビーズを磁気ビーズに混合して顕微注入することで、蛍光強度を指標して注入した磁気ビーズの量を定量化できる。顕微注入した磁気ビーズを捻転方向と逆から磁石で引っぱり、捻転運動を止める。このとき、磁性ビーズと磁石との間の距離を測定しておく(図2)。
- 捻転運動を止めたとき、磁性ビーズが受けていた「力」は捻転に必要な「力」と釣り合う「力」であったと考えられる。まず、捻転運動を止めたときに顕微注入した磁性ビーズの量から、磁性ビーズが受けていた「力」と磁石同士の距離の関係を示す式を得る。さらに、その式に磁石と磁性ビーズとの距離を代入することで、磁性ビーズが後腸内腔内で受けていた「力」を算出する。
- 最後に、磁性ビーズと回転軸からの距離、算出した「力」から、捻転トルクを算出する。
- 左右非対称性形成に関与する遺伝子の突然変異体における「力」の解析 松野研究室がこれまでに実施した遺伝的スクリーンにより、消化管の左右非対称性形成に関与する遺伝子の突然変異体が多数同定されている。これらの突然変異体では、消化管の捻転がほとんど起こらなかったり、その方向が反転する表現型が観察されたりする。これらの突然変異体で、消化管の形態が変化する際に必要な「力」を定量化することで、「力」と左右非対称性形成に関与する遺伝子との関係を明らかにする。
- 「力」によるパターン形成機構に関する研究 「力」が細胞に及ぼす影響に関して、培養細胞を用いた実験系では研究が進んでいるが、生体内における知見はあまり得られていない。そこで、ショウジョウバエ胚の発生過程において、顕微注入した磁気ビーズを用いて人為的に「力」を加え、そのときの遺伝子の発現パターンや、組織形態への影響を調べる。このようなアプローチによって、発生過程における「力」の役割を明らかにしていく。
(II) Notchシグナルの分子機構
Notch受容体(Notch)は、細胞と細胞の直接的な接触を介した細胞間シグナル(Notchシグナル)ではたらき、細胞運命決定や形態形成などで多彩な機能をはたしている。Notchシグナル経路の構成因子とそれらの機能は、ショウジョウバエから線虫まで進化的に広く保存されている。ヒトでのNotchシグナルの異常は、乳癌や大腸癌などの後天的な疾患の原因である。このようなことから、Notchシグナル伝達系に関する研究は、発生学や医学分野において重要である。Notchとそのリガンドは、ともに1回膜貫通型タンパク質である。隣接する細胞表面のリガンドが、Notchの細胞外ドメインに結合することで、Notchの活性化が誘発される。細胞膜に提示されたNotchがリガンドと結合すると、ADAM familyのプロテアーゼによる細胞外ドメインの切断を受ける(S2切断)。S2切断を受けたNotchは、さらに、γ-Secretaseによる膜貫通ドメインの切断を受ける(S3切断)。S3切断によって膜から遊離したNotch細胞内ドメインは核へと移行し、下流標的遺伝子のプロモーター上で転写複合体を形成し、それらの転写を活性化する。
これまでの研究によって、上で述べたNotchシグナルの主要な経路が明らかにされてきた。しかし、現在においても、Notchシグナル伝達やその制御に必須な新規遺伝子の同定が続いており、Notchシグナル伝達機構の理解は依然として不十分である。このことは、Notchシグナルの異常によって起こるヒト疾患の有効な治療法の開発の妨げとなっている。松野研究室では、Notchシグナル経路の新規構成因子の同定と、その機能の解明を目指して研究を進めている。
Notchシグナルの新規な構成因子の同定
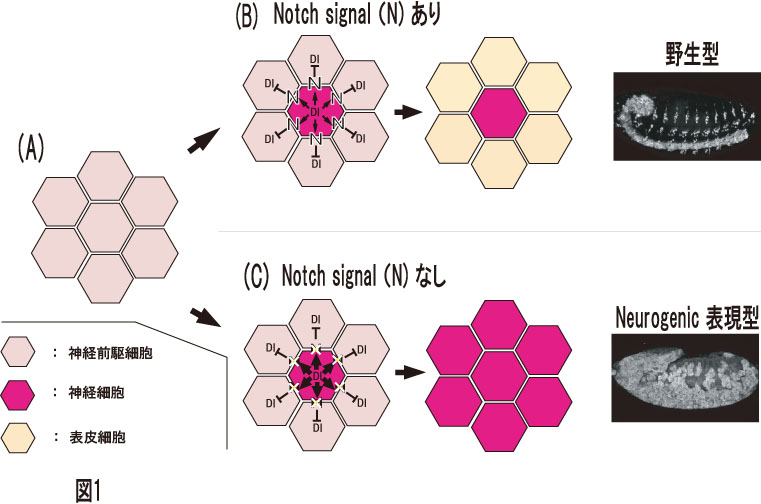 図1 神経過形成(Neurogenic表現型)の概念図。
図1 神経過形成(Neurogenic表現型)の概念図。 (A)神経前駆細胞ではすべての細胞が神経細胞に分化する能力を持ちます。(B)これらの細胞のうち、一部の細胞が神経細胞へと分化し始めると、NotchシグナルのリガンドであるDeltaを高発現し、周囲の細胞のNotchシグナルを活性化させます。これにより周囲の細胞は表皮細胞に分化します。この機構は側方抑制と呼ばれます。(C)しかし、Notchシグナルに欠損がある胚では、側方抑制が起こらないため、すべての細胞が神経細胞に分化してしまい、Neurogenic表現型を示します。
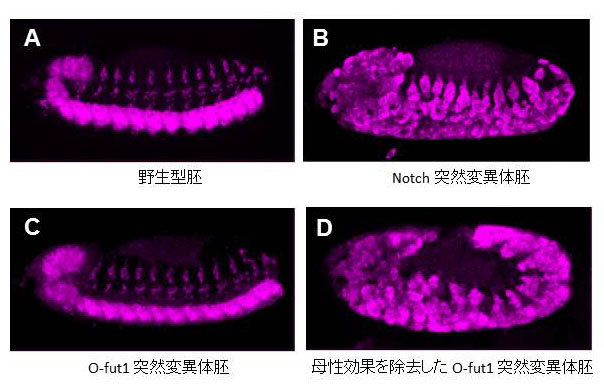 図2 Notch シグナルの欠損は、胚期において神経細胞の過形成、Neurogenic表現型をしめす。
図2 Notch シグナルの欠損は、胚期において神経細胞の過形成、Neurogenic表現型をしめす。それぞれ(A)野生型、(B) Notch突然変異体、(C)O-fut1突然変異体、(D)母性効果を除去した O-fut1突然変異体の胚を神経細胞特異的マーカーである抗Elav抗体で染色し、共焦点顕微鏡で観察した写真です。Notch突然変異体胚(B)および母性効果を欠失した O-fut1 突然変異体胚(D)では、神経細胞が過剰に形成されており、NotchとO-fut1はそれぞれ、Neurogenic遺伝子、母性 Neurogenic遺伝子に分類されます。
Notchシグナルの構成因子を模式的に示しています。これらの構成因子のうち、Neurogenic遺伝子は紫色、母性Neurogenic遺伝子は赤色で示しています。
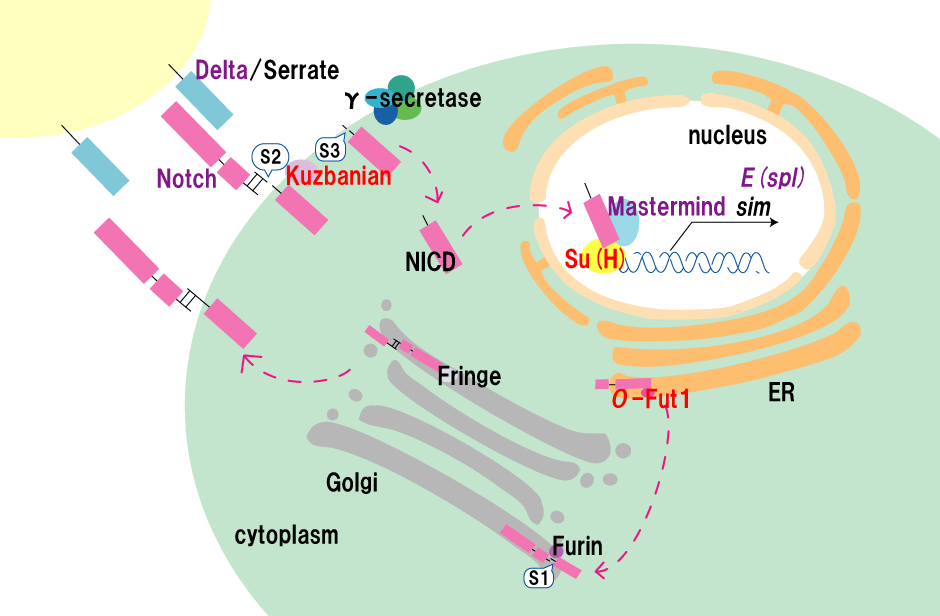 図3 Neurogenic遺伝子と母性Neurogenic遺伝子
図3 Neurogenic遺伝子と母性Neurogenic遺伝子Notchシグナルの構成因子を模式的に示しています。これらの構成因子のうち、Neurogenic遺伝子は紫色、母性Neurogenic遺伝子は赤色で示しています。
Notchシグナルの欠損によって引き起こされる表現型のうち、特によく解析されているのが、神経細胞の過形成(Neurogenic表現型)です(図1)。例えば、Notch 受容体遺伝子の突然変異体(Notch)のホモ接合体胚は、ほぼすべての表皮細胞が神経細胞に分化し、神経細胞が過剰に生み出されます(図2B)。このNeurogenic表現型を指標として、Notch シグナルの構成因子やその標的遺伝子が同定されました(図3)。しかしながら、ショウジョウバエの胚では、母性効果と呼ばれる、母親の体細胞から卵細胞へmRNAやタンパク質が供給される機構が存在します(図4)。
そのため、Notchシグナルの機能に必須な構成因子をコードする遺伝子の突然変異ホモ接合体胚でも、Neurogenic表現型を示さない遺伝子が存在します(図2)。これらを母性Neurogenic遺伝子と呼びます(図3)。松野研究室で同定され、現在もその機能の解析が行われているO-fut1も母性Neurogenic遺伝子です。母性Neurogenic遺伝子の突然変異体胚は、FLP-DSLと呼ばれる特別な手法を用いて、母性効果を除いた場合のみ、Neurogenic表現型を示します(図2、図4)。そのため、これまでに多くの研究室で行われてきた、突然変異体のホモ接合体胚のNeurogenic表現型を指標とした遺伝的スクリーニング(特定の表現型を示す突然変異を多数の突然変異から探索すること)では、母性Neurogenic遺伝子は単離できず、Notchシグナルの構成因子を同定する上での障害となってきました。
そこで、松野研究室では、Notchシグナルの新規構成因子を単離するために、母性Neurogenicスクリーンを行なっています。まず、化学変異誘発物質であるメタンスルホン酸エチル(EMS)によりランダムな突然変異を導入した突然変異系統を多数樹立します。次に、FLP-DSL法により、母性効果を除去した胚を作成し、それぞれの突然変異体胚に神経細胞の過形成が起こっているかを、調べていきます。このようにして、数千系統の突然変異系統の一次スクリーニングを行う予定です。
これまでに、200系統の突然変異について、遺伝的スクリーニングが終了しています。その結果、松野研究室でsplit-mindedと命名した新規な母性Neurogenic遺伝子の同定に成功しています。この遺伝子の機能を明らかにすることで、Notchシグナルの分子機構に関する理解が進むと考えられます。また、200系統のスクリーニングによって新規な母性Neurogenic遺伝子が同定できることが明らかになったことから、本スクリーニングが新規Notchシグナル構成因子を同定するための有効なアプローチであることがわかります。 Notchシグナルの構成因子を模式的に示しています。これらの構成因子のうち、Neurogenic遺伝子は紫色、母性Neurogenic遺伝子は赤色で示しています。
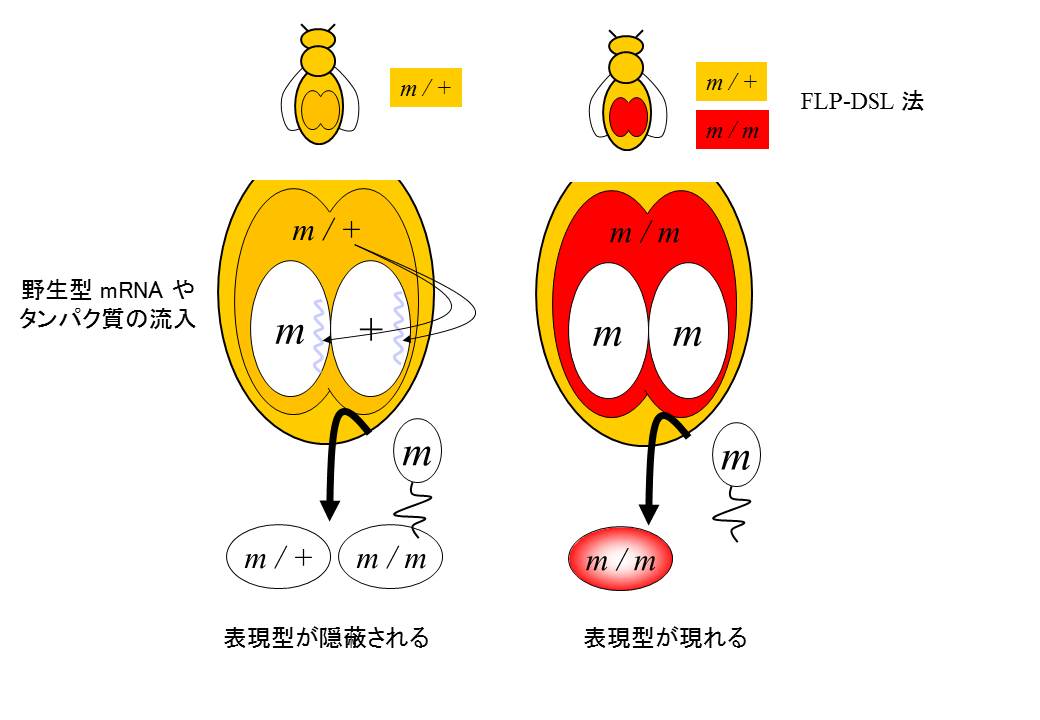
図4 母性効果の概念図
通常のヘテロ接合体 (m/+) のオスとメスを交配した場合、その胚の1/4は突然変異のホモ接合体 (m/m) になります。しかし、ショウジョウバエではメスの体細胞から、mRNAやタンパク質が卵母細胞に供給される機構があり、メスはヘテロ接合体であるため、野生型のmRNAやタンパク質がホモ接合体の胚に流入することになります(右)。それにより、一部の突然変異体胚では表現型が隠蔽されることになります。FLP-DSL法によりメスの卵巣細胞を突然変異ホモ細胞にすることにより、野生型のmRNAやタンパク質の流入が起こらなくなり、表現型が現れるようになります(左)。
A)神経前駆細胞ではすべての細胞が神経細胞に分化する能力を持ちます。(B)これらの細胞のうち、一部の細胞が神経細胞へと分化し始めると、NotchシグナルのリガンドであるDeltaを高発現し、周囲の細胞のNotchシグナルを活性化させます。これにより周囲の細胞は表皮細胞に分化します。この機構は側方抑制と呼ばれます。(C)しかし、Notchシグナルに欠損がある胚では、側方抑制が起こらないため、すべての細胞が神経細胞に分化してしまい、Neurogenic表現型を示します。
そこで、松野研究室では、Notchシグナルの新規構成因子を単離するために、母性Neurogenicスクリーンを行なっています。まず、化学変異誘発物質であるメタンスルホン酸エチル(EMS)によりランダムな突然変異を導入した突然変異系統を多数樹立します。次に、FLP-DSL法により、母性効果を除去した胚を作成し、それぞれの突然変異体胚に神経細胞の過形成が起こっているかを、調べていきます。このようにして、数千系統の突然変異系統の一次スクリーニングを行う予定です。
これまでに、200系統の突然変異について、遺伝的スクリーニングが終了しています。その結果、松野研究室でsplit-mindedと命名した新規な母性Neurogenic遺伝子の同定に成功しています。この遺伝子の機能を明らかにすることで、Notchシグナルの分子機構に関する理解が進むと考えられます。また、200系統のスクリーニングによって新規な母性Neurogenic遺伝子が同定できることが明らかになったことから、本スクリーニングが新規Notchシグナル構成因子を同定するための有効なアプローチであることがわかります。 Notchシグナルの構成因子を模式的に示しています。これらの構成因子のうち、Neurogenic遺伝子は紫色、母性Neurogenic遺伝子は赤色で示しています。

図4 母性効果の概念図
Notchの糖鎖修飾とその機能
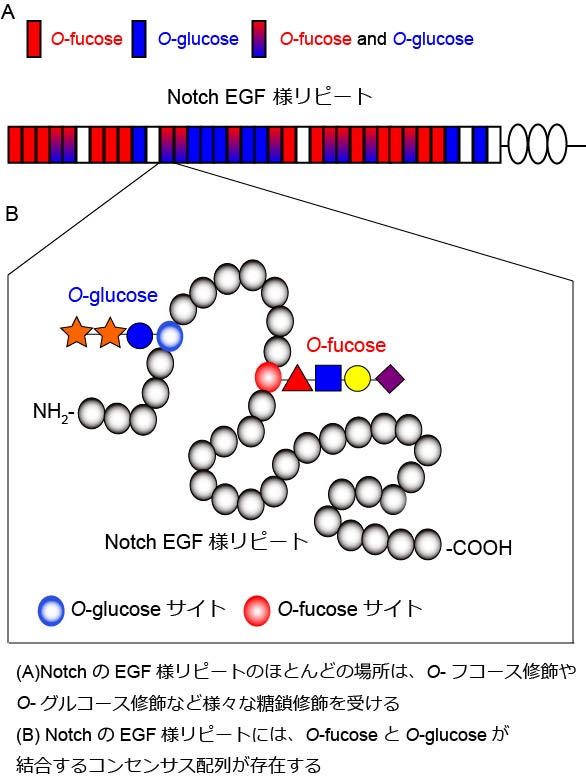
Notch受容体は、1回膜貫通型受容体であり、その細胞外ドメインには、36のepidermal growth factor (EGF) 様リピートが存在します。EGF様リピートは様々な糖鎖で修飾されています (図A)。最近の研究により、糖鎖が、多様な機能をもつこと明らかにされてきました。特に、タンパク質の糖鎖修飾は、癌、免疫、バイオ医薬などにおいて、重要な役割をはたしていることがわかっています。松野研究室では、Notchに対する糖鎖修飾のなかでも、O-結合型糖鎖修飾の機能に注目して研究を行っています。
Notchの細胞外ドメインのEGF様リピートのうち、C2X4-5S/TC3のコンセンサス配列をもつもののSer/Thr残基に、O-結合型のフコース修飾が起こります(図B)。このコンセンサス配列は、ショウジョウバエNotchの36のEGF様リピートのうち、23のEGF様リピートに存在します(図A)。 このO-フコースに、GlcNAc、Gal、Siaが順次付加され、4糖体が形成されます。また、NotchのEGF様リピートには、O-フコース以外にO-グルコースが付加されます。O-グルコース修飾は、EGF様リピートのうち、C1XSXPC2のコンセンサス配列をもっているものに起こります。このコンセンサス配列は、EGF様リピートのうち、18のEGF様リピートに存在します(図A)。 このO-グルコースには、さらにXylの付加が2度起こり、3糖体が形成されます。Notchに対するこれらO-結合型糖鎖の機能を明らかにすることで、糖鎖修飾の役割について一般化可能な多くの知見が得られると期待されます。
Notchの細胞外ドメインのEGF様リピートのうち、C2X4-5S/TC3のコンセンサス配列をもつもののSer/Thr残基に、O-結合型のフコース修飾が起こります(図B)。このコンセンサス配列は、ショウジョウバエNotchの36のEGF様リピートのうち、23のEGF様リピートに存在します(図A)。 このO-フコースに、GlcNAc、Gal、Siaが順次付加され、4糖体が形成されます。また、NotchのEGF様リピートには、O-フコース以外にO-グルコースが付加されます。O-グルコース修飾は、EGF様リピートのうち、C1XSXPC2のコンセンサス配列をもっているものに起こります。このコンセンサス配列は、EGF様リピートのうち、18のEGF様リピートに存在します(図A)。 このO-グルコースには、さらにXylの付加が2度起こり、3糖体が形成されます。Notchに対するこれらO-結合型糖鎖の機能を明らかにすることで、糖鎖修飾の役割について一般化可能な多くの知見が得られると期待されます。
